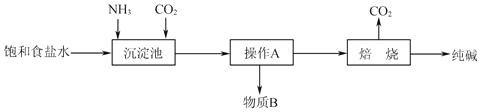
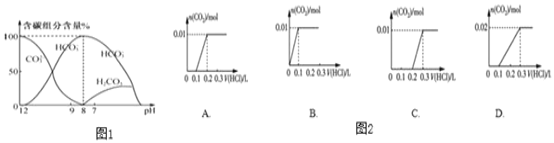
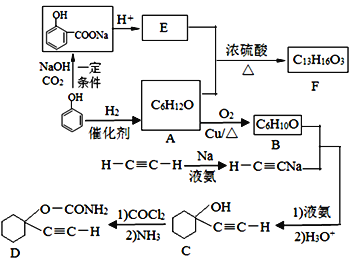
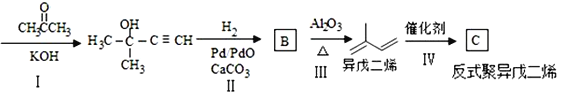
题目内容
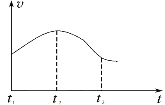
【题目】能源问题是当今世界的重要课题,研究反应中的能量变化尤为重要。下列变化过程中的能量变化符合图示过程的是( )

A.焦炭制水煤气B.酸碱中和反应
C.铝与氧化铁的高温反应D.浓硫酸的稀释
【答案】A
【解析】
根据图示可知变化过程中最终生成物质的能量比开始时反应物的能量高,该反应为吸热反应。
A.焦炭与水蒸气在高温下反应制水煤气的反应是吸热反应,生成物的能量比反应物的高,A符合题意;
B.酸碱中和反应是放热反应,反应物的能量比生成物的高,与图象不符合,B不符合题意;
C.铝与氧化铁的高温反应产生铁和氧化铝的反应是放热反应,反应物的能量比生成物的高,与图象不符合,C不符合题意;
D.浓硫酸的稀释会放出大量的热,没有发生化学反应,D不符合题意;
故合理选项是A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目