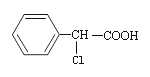
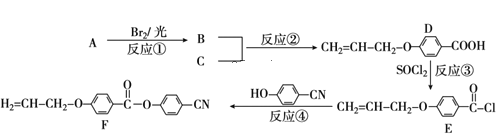
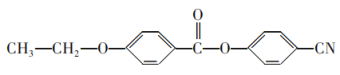
题目内容
【题目】把在空气中久置的铝片5.0g投入盛有50mL 0.1molL-1盐酸溶液的烧杯中,该铝片与盐酸反应,产生氢气的速率v(H2)与反应时间t的关系,可用如图所示的坐标曲线来表示,下列推论错误的是( )
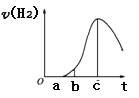
A.O→a段不产生氢气是因为表面的氧化物隔离了铝和稀盐酸
B.a→b段产生氢气的速率增加较快的主要原因之一是温度升高
C.t=c时刻,反应处于平衡状态
D.t>c,产生氢气的速率降低的主要原因是溶液中H+浓度下降
【答案】C
【解析】
空气中久置的铝片,表面会因被氧化而生成一层致密的氧化物薄膜,对内部的Al单质起到一定的保护作用;因此图像中,开始不生成氢气,是因为发生的是氧化铝与盐酸的反应;随后Al与盐酸反应生成氢气,开始温度较低,由于反应放热导致温度升高反应速率加快;再随后,氢离子浓度减小对反应速率的影响变得更为明显,所以又会出现反应速率减小的现象。
A.铝的表面有一层致密的Al2O3,对内部的Al单质起到一定的保护作用;因此图像中,开始不生成氢气,是因为发生的是氧化铝与盐酸的反应;A项正确;
B.在反应过程中,盐酸浓度减小,会导致反应速率减小;但由于反应放热会使溶液温度升高,从而导致反应速率加快,由于a→b阶段,反应速率是加快的,所以温度升高是其主要原因,B项正确;
C.Al与盐酸的反应不是可逆反应,所以不存在平衡状态,C项错误;
D.随着反应进行,体系内温度会升高,盐酸浓度会下降,因此t>c时,产生氢气速率下降的原因是盐酸浓度下降导致的,D项正确;
答案选C。

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
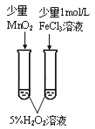
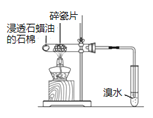
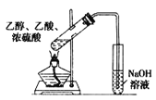
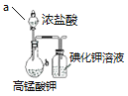
【题目】下列实验方案中,不能达到相应实验目的的是
A | B | C | D | |
方案 |
|
|
|
|
目的 | 验证不同催化剂对化学反应速率的影响 | 验证石蜡油分解的产物中含有与烷烃性质不同的烃 | 制备乙酸乙酯 | 比较Cl2、I2的氧化性 |
A.AB.BC.CD.D