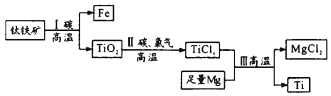
题目内容
【题目】在一定温度下,AgCl 与AgI的饱和溶液中存在如下关系,下列说法正确的是
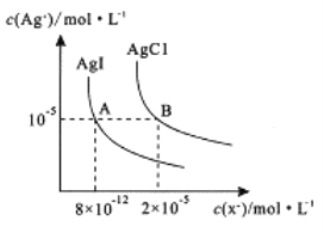
A. AgCl(s) +I-(aq)![]() AgI(s) +Cl-(aq),在该温度下的平衡常数K=2.5×106
AgI(s) +Cl-(aq),在该温度下的平衡常数K=2.5×106
B. 向0.1mol/LKI溶液中加入AgNO3 溶液,当I-刚好完全沉淀时,c(Ag+ )=2×10-12mol/L
C. 向AgCl、AgI的饱和溶液中加入氢碘酸溶液,可使溶液由A点变到B点
D. 向2 mL0.01mol/LAgNO3,溶液中加几滴0.01mol/L NaC1溶液,静置片刻,再向溶液中加几滴0.01mol/LKI溶液,有黄色沉淀生成,说明Ksp(AgCl)>Ksp(AgI)
【答案】A
【解析】根据图中数据可知:Ksp(AgCl)= c(Ag+) c(Cl-)= 10-5×2×10-5=2×10-10,Ksp(AgI)= c(Ag+) c(I-)= 10-5×8×10-12=8×10-17。A. AgCl(s)+I-(aq)![]() AgI(s)+Cl-(aq),在该温度下的平衡常数K=
AgI(s)+Cl-(aq),在该温度下的平衡常数K=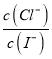 =
=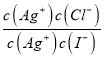 =
=![]() =
=![]() =2.5×106,选项A正确;B. 向0.1mol/LKI溶液中加入AgNO3溶液,当I-刚好完全沉淀时,c(Ag+)=
=2.5×106,选项A正确;B. 向0.1mol/LKI溶液中加入AgNO3溶液,当I-刚好完全沉淀时,c(Ag+)= ![]() =8×10-12mol/L,选项B错误;C. 向AgCl、AgI的饱和溶液中加入氢碘酸溶液,AgCl转化为AgI,氯离子浓度降低,不可能使溶液由A点变到B点,选项C错误;D. 向2mL0.01mol/LAgNO3,溶液中加几滴0.01mol/LNaC1溶液,静置片刻,再向溶液中加几滴0.01mol/LKI溶液,过量的银离子与碘离子反应,有黄色沉淀生成,而不一定是氯化银转化为碘化银,不能说明Ksp(AgCl)>Ksp(AgI),选项D错误。答案选A。
=8×10-12mol/L,选项B错误;C. 向AgCl、AgI的饱和溶液中加入氢碘酸溶液,AgCl转化为AgI,氯离子浓度降低,不可能使溶液由A点变到B点,选项C错误;D. 向2mL0.01mol/LAgNO3,溶液中加几滴0.01mol/LNaC1溶液,静置片刻,再向溶液中加几滴0.01mol/LKI溶液,过量的银离子与碘离子反应,有黄色沉淀生成,而不一定是氯化银转化为碘化银,不能说明Ksp(AgCl)>Ksp(AgI),选项D错误。答案选A。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】某同学用NaHCO3和KHCO3组成的混合物进实验,测得的实验数据如下表所示(盐酸的物质的量浓度相同):(计算结果保留3位有效数字)
实验编号 | ① | ② | ③ |
盐酸体积(mL) | 50 | 50 | 50 |
混合物的质量(g) | 9.2 | 15.7 | 27.6 |
标准状况下CO2的体积(L) | 2.24 | 3.36 | 3.36 |
回答下列问题:
(1)由实验______________(填实验编号)可判断盐酸完全反应,理由是_____________。
(2)盐酸的物质的量浓度为__________________。
(3)产生标准状况下3.36LCO2所需固体的质量为______________________。
【题目】一种通过铁基氧载体(Fe3O4/FeO)深度还原和再生来合成二甲醚(CH3OCH3)的原理如下图:

(1)二甲醚的合成反应:3CO(g)+3H2(g) ![]() CH3OCH3(g)+CO2(g) ΔH1
CH3OCH3(g)+CO2(g) ΔH1
①已知CO、H2与CH3OCH的燃烧热(ΔH)分别为a kJ·mol-1、b kJ·mol-1、c kJ·mol-1、(a、b、c均小于0),则ΔH1=________kJ·mol-1。
②该反应选用CuO/ZnO/Al2O3复合催化剂,该催化剂能_______(填标号)。
A.促进平衡正向移动 B.提高反应速率
C.降低反应的活化能 D.改变反应的焓变
(2)CH4氧化器中发生的主反应:
ⅰ. CH4(g)+Fe3O4(s)![]() CO(g)+2H2(g)+3Fe(s)
CO(g)+2H2(g)+3Fe(s)
ⅱ. CH4(g)+4Fe3O4(s)![]() CO2(g)+2H2O(g)+12FeO(s)
CO2(g)+2H2O(g)+12FeO(s)
850℃时,压强和部分气体体积分数、固相各组分质量分数的关系如下图。

①随着压强的增大,反应ⅰ的平衡常数K值________(填“增大”、“减小”、 或“不变”)
②结合图像,分析H2O的体积分数变化的原因_________(用化学方程式表示)
(3)将一定量的FeO和CO2置于CO2还原器(体积不变的密闭容器)中,发生的主反应:
CO2(g)+3FeO(s)![]() Fe3O4(s)+ CO (g) ΔH2
Fe3O4(s)+ CO (g) ΔH2
保持其他条件不变,测得不同温度下最终反应体系中CO、CO2体积分数如下表:
温度I/℃ | 100 | 170 | 200 | 300 | 400 | 500 |
CO2体积分数 | 0.67 | 0.67 | 0.75 | 0.82 | 0.9 | 0.92 |
CO体积分数 | 0.33 | 0.33 | 0.25 | 0.18 | 0.1 | 0.08 |
①ΔH2_______0(填“>”或“<”)。
②若在150℃时进行上述转化,理论转化率ɑ(FeO)=___________。
③在上述反应体系中,一定可以说明该反应达到平衡状态的是______(填标号)。
A.体系的压强不变 B.CO2的物质的量不变
C.CO的生成速率和消耗速率相等且不等于零 D.气体的平均摩尔质量不变
④根据化学反应原理,分析CO2还原器温度设置在170℃的原因___________。