题目内容
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、 E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
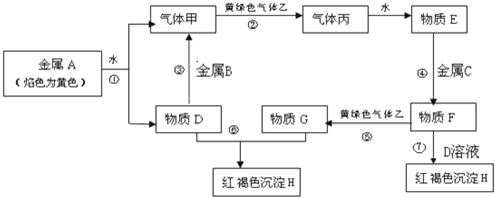
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:B__________、丙__________。
(2)说出黄绿色气体乙的一种用途:________________。反应过程⑦可能观察到的实验现象是________________。
(3)反应①的离子方程式为________________。
(4)反应③中的氧化剂是____________(写化学式,下同)反应④中的还原剂是____________。
(5)写出反应⑤的离子方程式:________________。
【答案】Al HCl 自来水消毒或者工业制盐酸、制备漂白粉等 白色沉淀→灰绿色→红褐色沉淀 2Na+2H2O=2Na++2OH+H2↑ H2O Fe 2Fe2++Cl2=2Fe3++2Cl-
【解析】
金属A焰色反应为黄色,故A为Na.Na与水反应生成D为NaOH、气体甲为H2.氢氧化钠与金属B反应生成氢气,故B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸。氢氧化钠与物质G反应生成红褐色沉淀H是Fe(OH)3,故物质G中含有Fe3+,金属C与盐酸反应得到F,F与氯气反应得到G,由元素守恒可知,金属C为Fe,故F为FeCl2,G为FeCl3,据此分析。
金属A焰色反应为黄色,故A为Na.Na与水反应生成D为NaOH、气体甲为H2.氢氧化钠与金属B反应生成氢气,故B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸。氢氧化钠与物质G反应生成红褐色沉淀H是Fe(OH)3,故物质G中含有Fe3+,金属C与盐酸反应得到F,F与氯气反应得到G,由元素守恒可知,金属C为Fe,故F为FeCl2,G为FeCl3。
(1)由以上分析可知,B为Al,丙为HCl,故答案为:Al;HCl;
(2)黄绿色气体乙为Cl2,可以用于自来水消毒或者工业制盐酸、制备漂白粉等,故答案为:自来水消毒或者工业制盐酸、制备漂白粉等;⑦可能观察到的实验现象为白色沉淀→灰绿色→红褐色沉淀,故答案为:白色沉淀→灰绿色→红褐色沉淀;
(3)反应①的离子方程式为:2Na+2H2O=2Na++2OH+H2↑,故答案为:2Na+2H2O=2Na++2OH+H2↑;
(4)反应③中的氧化剂是H2O,反应④中的还原剂是Fe;
(5)反应⑤的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案