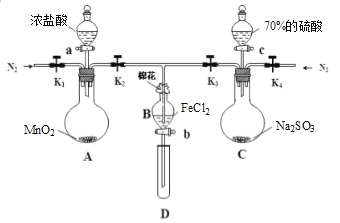
题目内容
【题目】Ⅰ.一定温度下,在容积为V L的密闭容器中进行反应:aN(g)![]() bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:

(1)此反应的化学方程式中a/b=___________;
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为_________________;
(3) N的平衡转化率为_______________;
(4)下列叙述中能说明上述反应达到平衡状态的是___________(填字母)。
a.反应中M与N的物质的量之比为1︰1
b.混合气体的总质量不随时间的变化而变化
c.混合气体的总物质的量不随时间的变化而变化
d.单位时间内每消耗a mol N,同时生成b mol M
e.混合气体的压强不随时间的变化而变化
f.N的质量分数在混合气体中保持不变
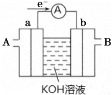
Ⅱ.研究性学习小组为探究铁与稀盐酸反应,取同质量、体积的铁片、同浓度的盐酸做了下列平行实验:
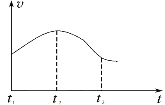
实验①:把纯铁片投入到盛有稀盐酸的试管中,发现放出氢气的速率变化如图所示:
实验②:把铁片投入到含FeCl3的同浓度稀盐酸中,发现放出氢气的量减少。
实验③:在稀盐酸中滴入几滴CuCl2溶液,用铁片做实验,发现生成氢气的速率加快。
试回答下列问题:
(1)分析实验①中t1~t2速率变化的主要原因是_______,t2~t3速率变化的主要原因是______。
(2)实验②放出氢气的量减少的原因是___________________(用离子方程式表示)。
(3)某同学认为实验③反应速率加快的主要原因是形成了原电池,你认为是否正确?请选择下列相应的a或b作答。a.若不正确,请说明原因_____________________________________。b.若正确,则写出实验③中原电池的正极电极反应式_______________________。
【答案】2 ![]() mol/(L·min) 75% cef 反应放热,溶液温度升高,反应速率加快 随反应进行,盐酸的浓度减小对反应速率的影响变得更明显,反应速率减慢 2Fe3++Fe=3Fe2+ 正确,实验③中加入CuCl2后铁和CuCl2反应生成Cu,Fe和Cu形成了原电池,所以反应速率加快 2H++2e-=H2↑
mol/(L·min) 75% cef 反应放热,溶液温度升高,反应速率加快 随反应进行,盐酸的浓度减小对反应速率的影响变得更明显,反应速率减慢 2Fe3++Fe=3Fe2+ 正确,实验③中加入CuCl2后铁和CuCl2反应生成Cu,Fe和Cu形成了原电池,所以反应速率加快 2H++2e-=H2↑
【解析】
Ⅰ(1)对于同一反应在相同时间内,各物质的物质的量的变化之比等同于相应的化学计量系数比;
(2)此题在计算反应速率时要注意两个问题,一是选取的时间段为t1~t2,二是图像中描述的是M物质的量的变化,而非物质的量浓度的变化;
(3)可根据图像判断出反应达到平衡时,转化的N的物质的量,进一步就能求出其转化率;
(4)判断该反应是否达到平衡状态时,要注意该反应是在恒温恒容的条件下进行的;另外,可逆反应达到平衡状态时,正逆反应速率相等,并且各物质的浓度或百分含量不再变化;
Ⅱ在分析反应速率变化的原因时,除内因外,要注意影响速率的外因包括温度,浓度,压强,催化剂,原电池以及接触面积等。
Ⅰ(1) 反应开始到平衡时,参加反应的N的物质的量为8mol-2mol=6mol,生成的M的物质的量是5mol-2mol=3mol,化学反应中物质的变化量之比等于化学计量数之比,所以此反应的化学方程式中a:b=6:3=2;
(2) 由图可知,t1到t2时刻M的物质的量变化为4mol-3mol=1mol,故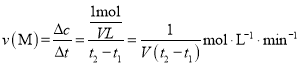 ;
;
(3) N的平衡转化率为![]() ;
;
(4)a.各物质的组成不再改变时,可逆反应会处于平衡状态,故若M与N的物质的量之比为1:1并且不再发生变化时,该反应才会处于平衡状态,a项错误;
b.该反应,因为反应物和生成物都是气体,所以混合气体的总质量始终不变,混合气体总质量不变不能说明达到平衡,b项错误;
c.由于a≠b,随反应进行混合气体总物质的量发生变化,混合气体的总物质的量不随时间的变化而变化,说明达到平衡,c项正确;
d.单位时间内消耗amolN,同时生成bmolM,都表示正反应速率,反应始终按此关系进行,该描述没有体现逆反应,所以不能说明达到平衡,d项错误;
e.由于a≠b,随反应进行混合气体总物质的量发生变化,根据公式![]() 可知,混合气体的压强不随时间的变化而变化,说明混合气体总的物质的量不再改变,说明反应达到平衡,e项正确;
可知,混合气体的压强不随时间的变化而变化,说明混合气体总的物质的量不再改变,说明反应达到平衡,e项正确;
f.N的质量分数若保持不变说明物质的组成不再发生变化,反应一定处于平衡状态,f项正确;
答案选cef;
Ⅱ(1)铁和盐酸反应是放热反应,所以实验①中t1~t2速率变化的主要原因是:反应放热,溶液温度升高,反应速率加快;t2~t3速率变化的主要原因是:随反应进行,盐酸的浓度减小对反应速率的影响变得更明显,因此反应速率减慢;
(2)实验②由于稀盐酸中含有FeCl3,其也可与Fe发生反应,所以导致氢气的量减少的原因是:2Fe3++Fe=3Fe2+;
(3) 实验③中加入CuCl2后铁和CuCl2反应生成Cu,Fe和Cu形成了原电池,所以反应速率加快,则该结论正确;其电极反应是:负极发生氧化反应:Fe-2e-=Fe2+;正极发生还原反应:2H++2e-=H2↑。