题目内容
2. 短周期元素X、Y、Z、W、E、Q在元素周期表中的位置如图所示,其中X、Y、Z三种元素的质子数之和为21.回答下列问题
短周期元素X、Y、Z、W、E、Q在元素周期表中的位置如图所示,其中X、Y、Z三种元素的质子数之和为21.回答下列问题| X | Y | Z | W |
| E | Q |
①Cl2O+H2O=2HClO②OF2+H2O═2HF+O2
(2)E元素的一种单质A,分子空间构型为正四面体,键角为60°,写出A(A被氧化成最高价含氧酸)与Y的最高价氧化物对应水化物的浓溶液在加热条件下反应的化学方程式3P4+20HNO3+8H2O=12H3PO4+20NO↑,工业上使用Ca3(EO4)2、石英砂和焦炭粉在电弧炉中熔烧还原得到A,化学方程式为:2Ca3(PO4)2+6SiO2+10C$\frac{\underline{\;电弧熔烧\;}}{\;}$P4+6CaSiO3+10CO↑.
(3)磷有多种化合物,次磷酸(H3PO2,为一元中强酸)和次磷酸钠(NaH2PO2)是化工生产中常用的还原剂.
①化学镀银,可利用H3PO2把溶液中的Ag+还原为银的反应,已知该反应中还原剂与氧化剂的物质的量之比为1:4,则氧化产物是H3PO4(填化学式).
②工业上可用白磷(P4)与Ba(OH)2溶液反应生成PH3和Ba(H2PO2)2.写出并配平该反应的化学方程式2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑,
如图是利用电解原理制备H3PO2的示意图;已知电极反应为:
阳极 4OH--4e→O2↑+H2O
阴极 2H++2e→H2↑):
分析在阳极室得到H3PO2原因:阳极反应中消耗水电离的OH-,使c(H+)增大,H2PO2-通过阴离子交换膜进入阳极室,得到产品.
分析 X、Y、Z三种元素位于相同周期且相邻,设X的原子序数为n,则Y、Z的原子序数分别为n+1、n+2,则n+n+1+n+2=21,n=6,则X为C元素,Y为N元素,Z为O元素,由W在周期表中的位置可知为F元素,Y与E在同一主族,且E在Y的下一周期,所以E为P元素,W与Q在同一主族,且Q在W的下一周期,所以Q为Cl元素.
(1)Q2Z为Cl2O和水反应生成次氯酸,ZW2为OF2与水反应生成氢氟酸和氧气,据此书写化学方程式;
(2)E元素的一种单质A,分子空间构型为正四面体,键角为60°,为白磷,Y的最高价氧化物对应水化物为硝酸,两者发生氧化还原反应,磷被氧化成最高价含氧酸磷酸,氮被还原成一氧化氮,石英砂成分为二氧化硅,Ca3(EO4)2、石英砂和焦炭粉在电弧炉中熔烧还原得到白磷,硅酸钙、一氧化碳,据此书写方程式;
(3)①H3PO2和AgNO3溶液反应进行化学镀银,此反应中氧化剂与还原剂的物质的量之比为4:1,结合化合价判断产物;
②根据反应物和生成物结合原子守恒和电子守恒书写方程式;根据图示“四室电渗析法”工作原理分析产品室可得到H3PO2的原因,阳极反应中消耗水电离的OH-,使c(H+)增大,H2PO2-通过阴离子交换膜进入阳极室,得到产品.
解答 解:X、Y、Z三种元素位于相同周期且相邻,设X的原子序数为n,则Y、Z的原子序数分别为n+1、n+2,则n+n+1+n+2=21,n=6,则X为C元素,Y为N元素,Z为O元素,由W在周期表中的位置可知为F元素,Y与E在同一主族,且E在Y的下一周期,所以E为P元素,W与Q在同一主族,且Q在W的下一周期,所以Q为Cl元素.
(1)Q2Z为Cl2O和水反应,反应为:Cl2O+H2O=2HClO,ZW2为OF2与水反应,反应为:OF2+H2O═2HF+O2,
故答案为:Cl2O+H2O=2HClO;OF2+H2O═2HF+O2;
(2)E为P元素,分子空间构型为正四面体,键角为60°的单质为白磷,Y为N元素,Y的最高价氧化物对应水化物为硝酸,具有氧化性,两者发生氧化还原反应,磷被氧化成最高价含氧酸磷酸,氮被还原成一氧化氮,反应为:3P4+20HNO3+8H2O=12H3PO4+20NO↑,石英砂成分为二氧化硅,Ca3(EO4)2、石英砂和焦炭粉在电弧炉中熔烧还原得到白磷,硅酸钙、一氧化碳,反应为:2Ca3(PO4)2+6SiO2+10C$\frac{\underline{\;电弧熔烧\;}}{\;}$P4+6CaSiO3+10CO↑,
故答案为:3P4+20HNO3+8H2O=12H3PO4+20NO↑;2Ca3(PO4)2+6SiO2+10C$\frac{\underline{\;电弧熔烧\;}}{\;}$P4+6CaSiO3+10CO↑;
(3)①H3PO2中,氢元素为+1价,氧元素为-2价,依据化合价代数和为0,磷化合价为+1价,该反应中Ag+为氧化剂,H3PO2为还原剂,氧化剂与还原剂的物质的量之比为4:1,设反应产物中P的化合价为x,根据化合价升降相等可得,4×(1-0)=1×(x-1),解得x=5,所以氧化产物为+5价的H3PO4,
故答案为:H3PO4;
②白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,反应方程式为2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑,据电解反应式可知,阳极反应中消耗水电离的OH-,使c(H+)增大,H2PO2-通过阴离子交换膜进入阳极室,得到产品,
故答案为:2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑;阳极反应中消耗水电离的OH-,使c(H+)增大,H2PO2-通过阴离子交换膜进入阳极室,得到产品.
点评 本题考查结构性质位置关系应用、氧化还原反应方程式书写等知识,为高频考点,侧重于学生的分析能力的考查,根据位置判断元素所处的周期是推断关键,注意掌握元素周期表的结构与元素周期律,题目难度中等.

| A. | 碘升华 | B. | 溴蒸气被木炭吸附 | ||
| C. | 酒精溶于水 | D. | HCl气体溶于水 |
| A. | X、Y、Z三种元素可以组成一种盐 | |
| B. | Y和Z可以组成一种Y和Z的质量比为7:8的化合物 | |
| C. | 由X、Y、Z三种元素中的任意两种组成的具有10电子的微粒都有2种 | |
| D. | X和Z可以组成原子个数比分别为1:1和2:1常温下为液态的两种化合物 |
| A. | SO2和SiO2 | B. | SiH4和H2S | C. | NaCl和HCl | D. | CCl4和KCl |
| A. | 单质的颜色随核电荷数的增加逐渐加深 | |
| B. | 氢化物的稳定性随核电荷数的增加逐渐减弱 | |
| C. | 单质与水反应均可表示为X+H2O=HX+HXO | |
| D. | 随核电荷数的增加卤素原子的半径递增,卤素离子的还原性增强 |
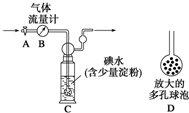 硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放.某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案:
硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放.某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案: