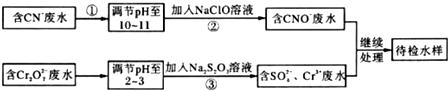
题目内容
11.为测定镁铝合金(不含其它元素)中镁的质量分数,某研究性学习小组设计了下列实验方案进行探究.请回答下列问题: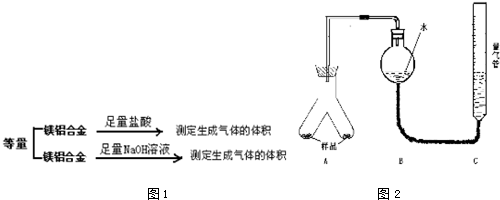
实验装置:如图2
实验步骤:
①按如图2连接好装置
②称取两份质量均为a g 的镁铝合金样品粉末,分别放入A装置左右两个管中,向B装置中加入一定量的水,把装置A、B的胶塞塞好,然后调节C的高度使B和C中的液面相平,记下此时的读数为V1ml
③用洁净的注射器向装置A左侧管中加入足量的稀盐酸,等不再有气泡产生时,调节装置C的高度,使B和C中的液面相平时记下此时的读数为V2 ml
④另取一洁净的注射器向装置A右侧管中加入足量的稀NaOH溶液,等不再有气泡产生时,调节装置C的高度,使B和C中的液面相平时记下此时的读数为V3 ml
问题和讨论:
(1)上述实验步骤①和②之间必须加一步检查气密性的操作,具体方法为向C中加入一定量水,然后提高C使其中液面高于B,静置一会儿,若液面不发生变化则气密性良好
(2)为使该实验方案测定结果尽可能准确,实验中应注意的问题是(只需写出一点)合金完全溶解(或加入足量盐酸,或调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积等合理答案)
(3)若a=0.30、V1=112、V2=448、V3=672,合金中镁的质量分数为40%
(4)某同学认为此实验可以省略步骤③也可以测出合金中镁的质量分数,他的评价是否合理,说出理由合理,合金中只有铝与氢氧化钠溶液反应,可以根据反应生成的氢气的量计算出铝的量,从而计算出镁的质量分数.
分析 (1)实验目的是通过测量气体体积计算合金中镁的质量分数,所以必须确保装置气密性良好;可以向C中进入少量水,根据液面变化判断装置气密性;
(2)合金是否完全溶解(或加入足量盐酸,或调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积)等会影响测定结果;
(3)镁、铝都与稀硫酸反应,二者生成氢气总体积为V2-V1,据此计算出氢气的物质的量,然后分别根据合金质量、生成氢气的量列式计算出二者的物质的量,再计算出镁的质量及质量分数;
(4)镁不与氢氧化钠溶液反应,可以根据生成的氢气计算出铝的物质的量,再计算出铝的质量分数,从而可以得出合金中镁的质量分数,所以可以省略③.
解答 解:(1)分析流程和步骤可知,该实验目的是通过测定气体体积的方法测定合金质量分数,故装置需要气密性完好,应对装置进行气密性检查,检查方法为:向C中加入一定量水,然后提高C使其中液面高于B,静置一会儿,若液面不发生变化则气密性良好;
故答案为:检查气密性;向C中加入一定量水,然后提高C使其中液面高于B,静置一会儿,若液面不发生变化则气密性良好;
(2)为使该实验方案测定结果尽可能准确,则必须保证合金完全溶解(或加入足量盐酸),还要调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积等,
故答案为:合金完全溶解(或加入足量盐酸,或调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积等合理答案);
(3)每份合金的质量a=0.30g,根据题中信息可知,进入足量稀硫酸后镁、铝都与稀硫酸反应,生成氢气总体积为:448mL-112mL=336mL,生成气体的物质的量为:$\frac{0.336L}{22.4L/mol}$=0.015mol,设镁的物质的量为x、铝的物质的量为y,则24x+27y=0.3、x+1.5y=0.015mol,解得:y=$\frac{0.02}{3}$mol、x=0.005mol,则合金中镁的质量为:24g/mol×0.005mol=0.12g,则合金中镁的质量分数为:$\frac{0.12g}{0.3g}$×100%=40%,
故答案为:40%;
(4)步骤④中的氢气为铝与氢氧化钠溶液反应生成的,可以根据氢气的体积计算出氢气的物质的量,然后计算出铝的物质的量、质量,从而得出合金中镁的质量及质量分数,所以可省略③,
故答案为:合理,合金中只有铝与氢氧化钠溶液反应,可以根据④中生成的氢气的量计算出铝的量,从而计算出镁的质量分数.
点评 本题考查了探究物质组成及含量的方法,题目难度中等,明确探究原理为解答关键,注意掌握常见的化学实验基本操作方法,试题侧重考查学生的分析、理解能力及化学实验、化学计算能力.

| A. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O | |
| C. | Fe (NO3)2与HI的反应:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O | |
| D. | 少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
 短周期元素X、Y、Z、W、E、Q在元素周期表中的位置如图所示,其中X、Y、Z三种元素的质子数之和为21.回答下列问题
短周期元素X、Y、Z、W、E、Q在元素周期表中的位置如图所示,其中X、Y、Z三种元素的质子数之和为21.回答下列问题| X | Y | Z | W |
| E | Q |
①Cl2O+H2O=2HClO②OF2+H2O═2HF+O2
(2)E元素的一种单质A,分子空间构型为正四面体,键角为60°,写出A(A被氧化成最高价含氧酸)与Y的最高价氧化物对应水化物的浓溶液在加热条件下反应的化学方程式3P4+20HNO3+8H2O=12H3PO4+20NO↑,工业上使用Ca3(EO4)2、石英砂和焦炭粉在电弧炉中熔烧还原得到A,化学方程式为:2Ca3(PO4)2+6SiO2+10C$\frac{\underline{\;电弧熔烧\;}}{\;}$P4+6CaSiO3+10CO↑.
(3)磷有多种化合物,次磷酸(H3PO2,为一元中强酸)和次磷酸钠(NaH2PO2)是化工生产中常用的还原剂.
①化学镀银,可利用H3PO2把溶液中的Ag+还原为银的反应,已知该反应中还原剂与氧化剂的物质的量之比为1:4,则氧化产物是H3PO4(填化学式).
②工业上可用白磷(P4)与Ba(OH)2溶液反应生成PH3和Ba(H2PO2)2.写出并配平该反应的化学方程式2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑,
如图是利用电解原理制备H3PO2的示意图;已知电极反应为:
阳极 4OH--4e→O2↑+H2O
阴极 2H++2e→H2↑):
分析在阳极室得到H3PO2原因:阳极反应中消耗水电离的OH-,使c(H+)增大,H2PO2-通过阴离子交换膜进入阳极室,得到产品.
| A. | E(4s)>E(3p)>E(3d) | B. | E(3s)>E(3p)>E(3d) | C. | E(6s)>E(4f)>E(5d) | D. | E(5s)>E(4p)>E(3d) |
| A. | 当n(Na)=n(Mg)=n(Al)=1mol时,①成立 | B. | 当n(Na)=n(Mg)=n(Al)=0.8mol时,②成立 | ||
| C. | 当n(Na)=n(Mg)=n(Al)=0.6mol时,③成立 | D. | 当n(Na)=n(Mg)=n(Al)=0.5mol时,④成立 |
| A. | NaOH | B. | NH3•H2O | C. | CuO | D. | BaCl2 |
| A. | 加入烧碱 | B. | 加热法 | ||
| C. | 加入AgNO3溶液 | D. | 利用溶解度不同,采用结晶法 |