题目内容
17.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )| A. | SO2和SiO2 | B. | SiH4和H2S | C. | NaCl和HCl | D. | CCl4和KCl |
分析 一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,含离子键的为离子晶体,含共价键且存在空间网状结构的为原子晶体,含共价键由分子构成的为分子晶体,以此来解答.
解答 解:A.固体SO2是分子晶体,二氧化硅是原子晶体,二氧化硅、二氧化碳都只含共价键,故A不选;
B.固体SiH4和H2S都是分子晶体,SiH4和H2S都只含共价键,故B选;
C.NaCl是离子晶体,NaCl中只含离子键,HCl的晶体为分子晶体,HCl中只含共价键,故C不选;
D.CCl4是分子晶体,CCl4中只含共价键,KCl是离子晶体,只含离子键,故D不选;
故选B.
点评 本题考查化学键,为高频考点,把握化学键形成的一般规律及化学键与晶体类型的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
7.下列说法中肯定错误的是( )
| A. | 某原子K层上只有一个电子 | |
| B. | 某原子M层上电子数为L层电子数的4倍 | |
| C. | 某离子M层上的电子数为K层的4倍 | |
| D. | 阴离子的最外层电子数可能为2,也可能为8 |
8.关于钠及其化合物性质的叙述,正确的是( )
| A. | 相同条件下,在水中碳酸钠的溶解度小于碳酸氢钠的溶解度 | |
| B. | 氧化钠和过氧化钠都能与二氧化碳反应,生成物完全相同 | |
| C. | 碳酸氢钠固体中混有少量碳酸钠,可用加热的方法除去 | |
| D. | 质量相等的碳酸钠和碳酸氢钠分别与足量盐酸反应,后者产生气体多 |
5.巴豆酸的结构简式为CH3CH=CHCOOH,现有①氯化氢 ②溴水 ③纯碱溶液 ④2-丙醇 ⑤酸性KMnO4溶液.在一定条件与巴豆酸反应的物质的组合是( )
| A. | 只有②④⑤ | B. | 只有①③④ | C. | ①②③④⑤ | D. | 只有①②③④ |
12.将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL 4.40mol/L盐酸中,充分反应后产生896mL H2(标准状况),残留固体1.28g.过滤,滤液中无Cu2+.将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L.则原混合物中单质铁的质量是( )
| A. | 2.24g | B. | 3.36g | C. | 5.60g | D. | 10.08g |
2. 短周期元素X、Y、Z、W、E、Q在元素周期表中的位置如图所示,其中X、Y、Z三种元素的质子数之和为21.回答下列问题
短周期元素X、Y、Z、W、E、Q在元素周期表中的位置如图所示,其中X、Y、Z三种元素的质子数之和为21.回答下列问题
(1)(4分)写出①Q2Z和②ZW2分别与水反应的化学方程式:
①Cl2O+H2O=2HClO②OF2+H2O═2HF+O2
(2)E元素的一种单质A,分子空间构型为正四面体,键角为60°,写出A(A被氧化成最高价含氧酸)与Y的最高价氧化物对应水化物的浓溶液在加热条件下反应的化学方程式3P4+20HNO3+8H2O=12H3PO4+20NO↑,工业上使用Ca3(EO4)2、石英砂和焦炭粉在电弧炉中熔烧还原得到A,化学方程式为:2Ca3(PO4)2+6SiO2+10C$\frac{\underline{\;电弧熔烧\;}}{\;}$P4+6CaSiO3+10CO↑.
(3)磷有多种化合物,次磷酸(H3PO2,为一元中强酸)和次磷酸钠(NaH2PO2)是化工生产中常用的还原剂.
①化学镀银,可利用H3PO2把溶液中的Ag+还原为银的反应,已知该反应中还原剂与氧化剂的物质的量之比为1:4,则氧化产物是H3PO4(填化学式).
②工业上可用白磷(P4)与Ba(OH)2溶液反应生成PH3和Ba(H2PO2)2.写出并配平该反应的化学方程式2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑,
如图是利用电解原理制备H3PO2的示意图;已知电极反应为:
阳极 4OH--4e→O2↑+H2O
阴极 2H++2e→H2↑):
分析在阳极室得到H3PO2原因:阳极反应中消耗水电离的OH-,使c(H+)增大,H2PO2-通过阴离子交换膜进入阳极室,得到产品.
 短周期元素X、Y、Z、W、E、Q在元素周期表中的位置如图所示,其中X、Y、Z三种元素的质子数之和为21.回答下列问题
短周期元素X、Y、Z、W、E、Q在元素周期表中的位置如图所示,其中X、Y、Z三种元素的质子数之和为21.回答下列问题| X | Y | Z | W |
| E | Q |
①Cl2O+H2O=2HClO②OF2+H2O═2HF+O2
(2)E元素的一种单质A,分子空间构型为正四面体,键角为60°,写出A(A被氧化成最高价含氧酸)与Y的最高价氧化物对应水化物的浓溶液在加热条件下反应的化学方程式3P4+20HNO3+8H2O=12H3PO4+20NO↑,工业上使用Ca3(EO4)2、石英砂和焦炭粉在电弧炉中熔烧还原得到A,化学方程式为:2Ca3(PO4)2+6SiO2+10C$\frac{\underline{\;电弧熔烧\;}}{\;}$P4+6CaSiO3+10CO↑.
(3)磷有多种化合物,次磷酸(H3PO2,为一元中强酸)和次磷酸钠(NaH2PO2)是化工生产中常用的还原剂.
①化学镀银,可利用H3PO2把溶液中的Ag+还原为银的反应,已知该反应中还原剂与氧化剂的物质的量之比为1:4,则氧化产物是H3PO4(填化学式).
②工业上可用白磷(P4)与Ba(OH)2溶液反应生成PH3和Ba(H2PO2)2.写出并配平该反应的化学方程式2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑,
如图是利用电解原理制备H3PO2的示意图;已知电极反应为:
阳极 4OH--4e→O2↑+H2O
阴极 2H++2e→H2↑):
分析在阳极室得到H3PO2原因:阳极反应中消耗水电离的OH-,使c(H+)增大,H2PO2-通过阴离子交换膜进入阳极室,得到产品.
9.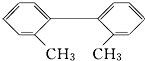 已知C-C键可以绕键轴自由旋转,对于结构简式为如图所示的烃,下列说法中正确的是( )
已知C-C键可以绕键轴自由旋转,对于结构简式为如图所示的烃,下列说法中正确的是( )
 已知C-C键可以绕键轴自由旋转,对于结构简式为如图所示的烃,下列说法中正确的是( )
已知C-C键可以绕键轴自由旋转,对于结构简式为如图所示的烃,下列说法中正确的是( )| A. | 分子中至少有8个碳原子处于同一平面上 | |
| B. | 分子中至少有9个碳原子处于同一平面上 | |
| C. | 该烃苯环上的一氯取代物最多有四种 | |
| D. | 该烃是苯的同系物 |
6.等物质的量的Na、Mg、Al分别与等物质的量的盐酸(1mol)反应生成H2,产生H2体积大小(相同状况)可出现下列四种情况:①Na>Mg=Al ②Na=Mg=Al ③Na<Mg=Al ④Na<Mg<Al,下列判断正确的是( )
| A. | 当n(Na)=n(Mg)=n(Al)=1mol时,①成立 | B. | 当n(Na)=n(Mg)=n(Al)=0.8mol时,②成立 | ||
| C. | 当n(Na)=n(Mg)=n(Al)=0.6mol时,③成立 | D. | 当n(Na)=n(Mg)=n(Al)=0.5mol时,④成立 |
7.将30mL一定浓度的硝酸与4.51g铜片反应,当铜片全部反应后,共生成2.24L气体(准标状况).则硝酸的物质的量浓度至少为( )
| A. | 9 mol/L | B. | 8 mol/L | C. | 5 mol/L | D. | 10 mol/L |