题目内容
10.已知X、Y、Z都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相等,而Z原子的最外层电子数是次外层的3倍,Y和Z可以形成两种以上常温下呈气态的化合物,则下列说法错误的是( )| A. | X、Y、Z三种元素可以组成一种盐 | |
| B. | Y和Z可以组成一种Y和Z的质量比为7:8的化合物 | |
| C. | 由X、Y、Z三种元素中的任意两种组成的具有10电子的微粒都有2种 | |
| D. | X和Z可以组成原子个数比分别为1:1和2:1常温下为液态的两种化合物 |
分析 X、Y、Z都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相等,则X是H元素;
Z原子的最外层电子数是次外层的3倍,最外层电子数不超过8个,则Z次外层为K层,为O元素;
Y和Z可以形成两种以上常温下呈气态的化合物,且原子序数Y大于H而小于O元素,所以Y为N元素,
A.X、Y、Z三种元素可以组成一种盐硝酸铵;
B.N和O可以组成一种N和O的质量比为7:8的化合物,两种元素的物质的量之比=$\frac{7}{14}:$$\frac{8}{16}$=1:1,物质的量之比等于原子个数之比,形成的化合物分子中N、O原子个数之比为1:1;
C.由H、N、O三种元素中的任意两种组成的具有10电子的微粒都有3种;
D.H和O可以组成原子个数比分别为1:1和2:1常温下为液态的两种化合物分别是双氧水和水.
解答 解:X、Y、Z都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相等,则X是H元素;
Z原子的最外层电子数是次外层的3倍,最外层电子数不超过8个,则Z次外层为K层,为O元素;
Y和Z可以形成两种以上常温下呈气态的化合物,且原子序数Y大于H而小于O元素,所以Y为N元素,
A.X、Y、Z三种元素可以组成一种盐,为硝酸铵,故A正确;
B.N和O可以组成一种N和O的质量比为7:8的化合物,两种元素的物质的量之比=$\frac{7}{14}:$$\frac{8}{16}$=1:1,物质的量之比等于原子个数之比,形成的化合物分子中N、O原子个数之比为1:1,该化合物为NO,故B正确;
C.由H、N、O三种元素中的任意两种组成的具有10电子的微粒都有3种,分别为NH3、NH2-、NH4+、H2O、H3O+、OH-,故C错误;
D.H和O可以组成原子个数比分别为1:1和2:1常温下为液态的两种化合物分别是双氧水和水,分子式分别为H2O2、H2O,故D正确;
故选C.
点评 本题考查原子结构和元素性质,侧重考查元素周期表结构、原子结构及微粒结构是解本题关键,同时考查学生发散思维能力,易错选项是C,知道常见10电子微粒,题目难度中等.

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 关系相互转化的是(“→”表示一步完成)( )
关系相互转化的是(“→”表示一步完成)( )| 选项 | A | B | C | D |
| a | SiO2 | NaOH | HNO3 | Cu |
| b | Na2SiO3 | Na2CO3 | NO | CuSO4 |
| c | H2SiO3 | NaHCO3 | NO2 | Cu(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O | |
| C. | Fe (NO3)2与HI的反应:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O | |
| D. | 少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
| A. | 只有②④⑤ | B. | 只有①③④ | C. | ①②③④⑤ | D. | 只有①②③④ |
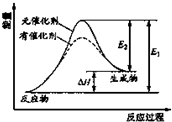 某反应的过程中能量辩护如图实数(图中E1表示正反应的活化能,E2表示逆反应的活化能),下列叙述制取的是( )
某反应的过程中能量辩护如图实数(图中E1表示正反应的活化能,E2表示逆反应的活化能),下列叙述制取的是( )| A. | 该反应为放热反应 | |
| B. | 催化解能改变反应的焓变 | |
| C. | 催化解能降低反应所需活化能,增大活化分子百分数 | |
| D. | 逆反应的活化能大于正反应的活化能 |
 短周期元素X、Y、Z、W、E、Q在元素周期表中的位置如图所示,其中X、Y、Z三种元素的质子数之和为21.回答下列问题
短周期元素X、Y、Z、W、E、Q在元素周期表中的位置如图所示,其中X、Y、Z三种元素的质子数之和为21.回答下列问题| X | Y | Z | W |
| E | Q |
①Cl2O+H2O=2HClO②OF2+H2O═2HF+O2
(2)E元素的一种单质A,分子空间构型为正四面体,键角为60°,写出A(A被氧化成最高价含氧酸)与Y的最高价氧化物对应水化物的浓溶液在加热条件下反应的化学方程式3P4+20HNO3+8H2O=12H3PO4+20NO↑,工业上使用Ca3(EO4)2、石英砂和焦炭粉在电弧炉中熔烧还原得到A,化学方程式为:2Ca3(PO4)2+6SiO2+10C$\frac{\underline{\;电弧熔烧\;}}{\;}$P4+6CaSiO3+10CO↑.
(3)磷有多种化合物,次磷酸(H3PO2,为一元中强酸)和次磷酸钠(NaH2PO2)是化工生产中常用的还原剂.
①化学镀银,可利用H3PO2把溶液中的Ag+还原为银的反应,已知该反应中还原剂与氧化剂的物质的量之比为1:4,则氧化产物是H3PO4(填化学式).
②工业上可用白磷(P4)与Ba(OH)2溶液反应生成PH3和Ba(H2PO2)2.写出并配平该反应的化学方程式2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑,
如图是利用电解原理制备H3PO2的示意图;已知电极反应为:
阳极 4OH--4e→O2↑+H2O
阴极 2H++2e→H2↑):
分析在阳极室得到H3PO2原因:阳极反应中消耗水电离的OH-,使c(H+)增大,H2PO2-通过阴离子交换膜进入阳极室,得到产品.
| A. | E(4s)>E(3p)>E(3d) | B. | E(3s)>E(3p)>E(3d) | C. | E(6s)>E(4f)>E(5d) | D. | E(5s)>E(4p)>E(3d) |
| A. | NaOH | B. | NH3•H2O | C. | CuO | D. | BaCl2 |
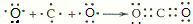 ;用电子式表示C、D两元素形成化学键的过程
;用电子式表示C、D两元素形成化学键的过程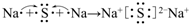 .
.