题目内容
7.有A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20,其中C、E是金属元素;A和E元素原子的最外电子层都只有一个电子;B和D元素原子的最外层电子数相同,且B元素原子L层电子数是K层电子数的3倍;C元素原子的最外层电子数是D元素原子最外层电子数的一半.(1)据此推断这五种元素的元素符号.
A.H;B.O;C.Al;D.S;E.K.
(2)分别写出C的最高价氧化物对应水化物与D、E最高价氧化物对应水化物反应的离子方程式:
Al(OH)3+3H+═Al3++3H2O、Al(OH)3+OH-═AlO2-+2H2O.
分析 A、B、C、D、E五种短周期元素,它们的核电荷数依次增大,且都小于20,B和D原子的最外层电子数相同,二者处于同主族,且B原子L层电子数是K层电子数的3倍,则B原子L层电子数为6,则B为氧元素、D为硫元素;
C、E是金属元素,D为硫元素,C元素原子的最外层电子数是D元素原子最外层电子数的一半(6×$\frac{1}{2}$=3),则C为铝元素元素;
A和E原子的最外层电子都只有一个,二者处于ⅠA族,结合原子序数可知,E原子序数大于铝元素,E为K元素,A为氢元素,据此解答.
解答 解:(1)A、B、C、D、E五种短周期元素,它们的核电荷数依次增大,且都小于20,B和D原子的最外层电子数相同,二者处于同主族,且B原子L层电子数是K层电子数的3倍,则B原子L层电子数为6,则B为氧元素、D为硫元素;
C、E是金属元素,D为硫元素,C元素原子的最外层电子数是D元素原子最外层电子数的一半(6×$\frac{1}{2}$=3),则C为铝元素元素;
A和E原子的最外层电子都只有一个,二者处于ⅠA族,结合原子序数可知,E原子序数大于铝元素,E为K元素,A为氢元素,
故答案为:H;O;Al;S;K;
(2)C为铝元素元素,最高价氧化物对应水化物为Al(OH)3,D为硫元素最高价氧化物对应水化物为H2SO4,E为钾元素最高价氧化物对应水化物为KOH,氢氧化铝具有两性,既能和酸反应,又能和碱反应,它们间反应的离子方程式为:Al(OH)3+3H+═Al3++3H2O、Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+3H+═Al3++3H2O;Al(OH)3+OH-═AlO2-+2H2O.
点评 本题考查结构性质位置关系,元素的推断是解答的关键,题目难度不大,注意信息的综合应用来推断,较好的训练学生分析解决问题的能力,旨在考查学生对基础知识的掌握.

 走进文言文系列答案
走进文言文系列答案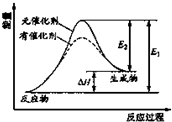 某反应的过程中能量辩护如图实数(图中E1表示正反应的活化能,E2表示逆反应的活化能),下列叙述制取的是( )
某反应的过程中能量辩护如图实数(图中E1表示正反应的活化能,E2表示逆反应的活化能),下列叙述制取的是( )| A. | 该反应为放热反应 | |
| B. | 催化解能改变反应的焓变 | |
| C. | 催化解能降低反应所需活化能,增大活化分子百分数 | |
| D. | 逆反应的活化能大于正反应的活化能 |
 短周期元素X、Y、Z、W、E、Q在元素周期表中的位置如图所示,其中X、Y、Z三种元素的质子数之和为21.回答下列问题
短周期元素X、Y、Z、W、E、Q在元素周期表中的位置如图所示,其中X、Y、Z三种元素的质子数之和为21.回答下列问题| X | Y | Z | W |
| E | Q |
①Cl2O+H2O=2HClO②OF2+H2O═2HF+O2
(2)E元素的一种单质A,分子空间构型为正四面体,键角为60°,写出A(A被氧化成最高价含氧酸)与Y的最高价氧化物对应水化物的浓溶液在加热条件下反应的化学方程式3P4+20HNO3+8H2O=12H3PO4+20NO↑,工业上使用Ca3(EO4)2、石英砂和焦炭粉在电弧炉中熔烧还原得到A,化学方程式为:2Ca3(PO4)2+6SiO2+10C$\frac{\underline{\;电弧熔烧\;}}{\;}$P4+6CaSiO3+10CO↑.
(3)磷有多种化合物,次磷酸(H3PO2,为一元中强酸)和次磷酸钠(NaH2PO2)是化工生产中常用的还原剂.
①化学镀银,可利用H3PO2把溶液中的Ag+还原为银的反应,已知该反应中还原剂与氧化剂的物质的量之比为1:4,则氧化产物是H3PO4(填化学式).
②工业上可用白磷(P4)与Ba(OH)2溶液反应生成PH3和Ba(H2PO2)2.写出并配平该反应的化学方程式2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑,
如图是利用电解原理制备H3PO2的示意图;已知电极反应为:
阳极 4OH--4e→O2↑+H2O
阴极 2H++2e→H2↑):
分析在阳极室得到H3PO2原因:阳极反应中消耗水电离的OH-,使c(H+)增大,H2PO2-通过阴离子交换膜进入阳极室,得到产品.
| A. | 甲烷和甲酸甲酯 | B. | 乙烷和乙醇 | C. | 苯和苯酚 | D. | 乙炔和苯 |
| A. | E(4s)>E(3p)>E(3d) | B. | E(3s)>E(3p)>E(3d) | C. | E(6s)>E(4f)>E(5d) | D. | E(5s)>E(4p)>E(3d) |
| A. | 元素A、B只能形成一种化合物 | |
| B. | 一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应 | |
| C. | 工业上常用电解法制备元素C、D的单质 | |
| D. | 化合物AE与CE含有相同类型的化学键 |
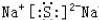 .
.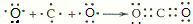 ;用电子式表示C、D两元素形成化学键的过程
;用电子式表示C、D两元素形成化学键的过程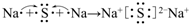 .
.