题目内容
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度变化如图所示。据图分析,下列判断正确的是( )
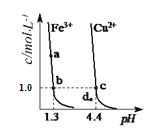
A. Ksp[Cu(OH)2]数量级为10-20
B. d点表示Cu(OH)2形成饱和溶液
C. 加适量NH4Cl固体可使溶液由a点变到b点
D. b、c两点表示Fe(OH)3、Cu(OH)2溶解度相等
【答案】A
【解析】
A.由c点可知Ksp[Cu(OH)2]=c(Cu2+)·c2(OH-)=1.0×(10-9.6)2=10-19.2,因此氢氧化铜的溶度积常数的数量级为10-20,A正确;
B.曲线为沉淀溶解平衡曲线,曲线上的点为平衡点,曲线上方的点为过饱和溶液,曲线下方的浓度积常数未达到溶度积常数的值,因此形成的不是饱和溶液,所以d点表示Cu(OH)2形成的不饱和溶液,B错误;
C.加适量NH4Cl固体,NH4+与OH-结合形成NH3·H2O,导致溶液中c(OH-)减小,因此不能使溶液由a点变到b点,C错误;
D. b、c两点表示其中的金属阳离子的浓度相等,由于Fe(OH)3、Cu(OH)2的溶度积常数不同,所以不能表示二者的溶解度相等,D错误;
故合理选项是A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】下列“实际应用”对应“化学知识原理”说法错误的是( )
选项 | 实际应用 | 化学知识原理 |
A | 泡沫灭火器中装有碳酸氢钠溶液 和硫酸铝溶液 | 碳酸氢钠溶液和硫酸铝溶液水解且相互促进 |
B | 工业上采用高压(20-50MPa)合成NH3 | 应用勒夏特列原理 |
C | 施加石膏降低盐碱地(含Na2CO3)的碱性 | CaCO3溶度积小于CaSO4 |
D | 选用金属锂做电池电极材料 | 锂轻且在空气中稳定 |
A. AB. BC. CD. D