题目内容
【题目】如图是Cu-Zn原电池的装置示意图,下列叙述正确的是( )
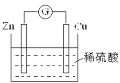
A.Zn片是正极
B.H+在铜片上得电子
C.反应过程中电能转变为化学能
D.电子从锌片通过硫酸溶液流向铜片
【答案】B
【解析】
Cu-Zn-稀硫酸原电池放电时,化学能转变为电能,较活泼的金属锌作负极,较不活泼的金属铜作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极。
A.Cu-Zn-稀硫酸原电池放电时,较活泼的金属锌作负极,负极上失电子发生氧化反应,故A错误;
B.较不活泼的金属铜作正极,正极H+在铜片上得电子发生还原反应,故B正确;
C.该原电池放电时,化学能转变为电能,故C错误;
D.电子从负极锌片沿导线流向正极铜片,不经过溶液,故D错误。
故选B。

 名校课堂系列答案
名校课堂系列答案【题目】某温度下,在 2 L 恒容密闭容器中 3 种物质间进行反应,X、Y、Z 的物质的量随时间的变化曲线如图所示,反应在 t1 min 时达到平衡。
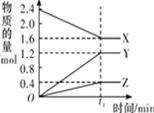
(1)请写出该反应的化学方程式:____________________________
(2)若上述反应中X、Y、Z 分别为NH3、H2、N2的一种,在此t1 min 时间内,用H2 表示该反应的平均速率υ(H2)为____________________________
(3)拆开 1mol 共价键所需吸收的能量如下表:
共价键 | H-H | N≡N | N-H |
吸收的能量/kJ | 436 | 946 | 391 |
1mol N2 完全反应生成NH3__________(填:吸收或放出多少)kJ 能量。但事实上,将 1molN2 和3molH2放在反应容器中,使它们充分反应,反应的热量变化总小于计算值,原因是________________________________
(4)下列叙述能判断该反应达到平衡状态的是___________(填字母代号)。
A.容器内各气体组分的质量分数不再发生改变
B.容器内气体的压强不再发生改变
C.容器内气体的密度不再发生改变
D.混合气体的平均相对分子质量不再发生改变
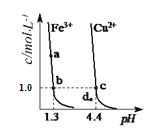
【题目】如图是物质间发生化学反应的颜色变化,其中物质a、b、c、d对应的物质正确的是( )
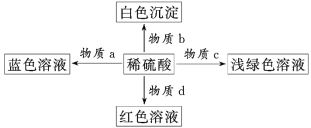
选项 | 物质a | 物质b | 物质c | 物质d |
A | Cu2(OH)2CO3 | Ba(OH)2 | Fe(OH)3 | 酚酞溶液 |
B | CuO | NaAlO2 | Fe2O3 | 紫色石蕊溶液 |
C | CuO | BaCl2 | FeO | 酚酞溶液 |
D | Cu(OH)2 | Ba(NO3)2 | FeO | 紫色石蕊溶液 |
A. AB. BC. CD. D
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠、碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:____。
(2)在钠、碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是_____。
(3)吸收液吸收SO2的过程中,pH随n(SO32-)∶n(HSO3-)变化关系如表:
n(SO32-)∶n(HSO3-) | 91∶9 | 1∶1 | 1∶91 |
pH | 8.2 | 7.2 | 6.2 |
上表判断NaHSO3溶液显___性,用化学平衡原理解释:___。