题目内容
【题目】0.1000mol/L的盐酸滴定20 mL0.1000mol/L氨水,滴定曲线如下图,下列说法正确的是( )
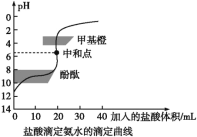
A. 该中和滴定适宜用酚酞作指示剂
B. 两者恰好中和时,溶液的pH=7
C. 达到滴定终点时,溶液中:c(H+)=c(OH-)+c(NH3·H2O)
D. 当滴入盐酸达40 mL时,溶液中c(NH4+)+c(H+)=c(Cl-)
【答案】C
【解析】
A.用0.1000mol/L的盐酸滴定20 mL0.1000mol/L氨水,恰好完全反应产生NH4Cl是强酸弱碱盐,水解使溶液显酸性,为减少滴定误差,要选择在酸性范围内变色的指示剂甲基橙,A错误;
B.两者恰好中和时产生是NH4Cl,该盐是强酸弱碱盐,水解使溶液显酸性,溶液的pH<7,B错误;
C.达到滴定终点时,NH4+水解使溶液显酸性,根据质子守恒,可得:c(H+)=c(OH-)+c(NH3·H2O),C正确;
D.当滴入盐酸达40 mL时,溶液中含有等物质的量浓度的NH4Cl、NH3·H2O,根据电荷守恒可得c(NH4+)+c(H+)=c(Cl-)+c(OH-),D错误;
故合理选项是C。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案【题目】某温度下,在 2 L 恒容密闭容器中 3 种物质间进行反应,X、Y、Z 的物质的量随时间的变化曲线如图所示,反应在 t1 min 时达到平衡。
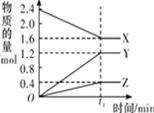
(1)请写出该反应的化学方程式:____________________________
(2)若上述反应中X、Y、Z 分别为NH3、H2、N2的一种,在此t1 min 时间内,用H2 表示该反应的平均速率υ(H2)为____________________________
(3)拆开 1mol 共价键所需吸收的能量如下表:
共价键 | H-H | N≡N | N-H |
吸收的能量/kJ | 436 | 946 | 391 |
1mol N2 完全反应生成NH3__________(填:吸收或放出多少)kJ 能量。但事实上,将 1molN2 和3molH2放在反应容器中,使它们充分反应,反应的热量变化总小于计算值,原因是________________________________
(4)下列叙述能判断该反应达到平衡状态的是___________(填字母代号)。
A.容器内各气体组分的质量分数不再发生改变
B.容器内气体的压强不再发生改变
C.容器内气体的密度不再发生改变
D.混合气体的平均相对分子质量不再发生改变