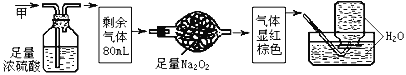
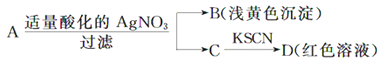
题目内容
【题目】下列粒子中,中心原子杂化轨道类型相同,粒子的空间构型也相同的是( )
A. PCl3、BCl3B. H3O+、SO3
C. BeCl2、CS2D. NH3、CH4
【答案】C
【解析】
A.根据价层电子对互斥理论确定中心原子杂化类型,PCl3中P价层电子对个数=3+![]() (5-3×1)=4,采取sp3杂化,P存在1个孤电子对,因而PCl3空间构型为三角锥形,BCl3中B价层电子对个数=3+
(5-3×1)=4,采取sp3杂化,P存在1个孤电子对,因而PCl3空间构型为三角锥形,BCl3中B价层电子对个数=3+![]() (3-3×1)=3,采取sp2杂化,B电子均成键,因而BCl3空间构型是平面三角形,A错误;
(3-3×1)=3,采取sp2杂化,B电子均成键,因而BCl3空间构型是平面三角形,A错误;
B.H3O+中O价层电子对个数=3+![]() (6-1-3×1)=4,采取sp3杂化,且O含有1个孤电子对,H3O+空间构型为三角锥形,SO3中S价层电子对个数=3+
(6-1-3×1)=4,采取sp3杂化,且O含有1个孤电子对,H3O+空间构型为三角锥形,SO3中S价层电子对个数=3+![]() (6-3×2)=3,采取sp2杂化,不存在孤对电子,SO3空间构型为平面三角形,B错误;
(6-3×2)=3,采取sp2杂化,不存在孤对电子,SO3空间构型为平面三角形,B错误;
C.BeCl2中Be价层电子对个数=2+![]() (2-2×1)=2,采取sp杂化,不存在孤对电子,BeCl2空间构型为直线型,CS2中C价层电子对个数=2+
(2-2×1)=2,采取sp杂化,不存在孤对电子,BeCl2空间构型为直线型,CS2中C价层电子对个数=2+![]() (4-2×2)=2,采取sp杂化,不存在孤对电子,CS2空间构型为直线型,C正确;
(4-2×2)=2,采取sp杂化,不存在孤对电子,CS2空间构型为直线型,C正确;
D.NH3中N价层电子对个数=3+![]() (5-3×1)=4,采取sp3杂化,N含有1个孤电子对,NH3空间构型为三角锥形,CH4中C价层电子对个数=4+
(5-3×1)=4,采取sp3杂化,N含有1个孤电子对,NH3空间构型为三角锥形,CH4中C价层电子对个数=4+![]() (4-4×1)=4,采取sp3杂化,不存在孤对电子,CH4空间构型为正四面体型,D错误。
(4-4×1)=4,采取sp3杂化,不存在孤对电子,CH4空间构型为正四面体型,D错误。
故答案选C。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案【题目】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠、碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:____。
(2)在钠、碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是_____。
(3)吸收液吸收SO2的过程中,pH随n(SO32-)∶n(HSO3-)变化关系如表:
n(SO32-)∶n(HSO3-) | 91∶9 | 1∶1 | 1∶91 |
pH | 8.2 | 7.2 | 6.2 |
上表判断NaHSO3溶液显___性,用化学平衡原理解释:___。