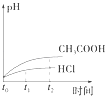
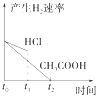
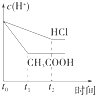
题目内容
【题目】在一定条件下发生反应2SO3(g)![]() 2SO2(g)+O2(g),将1molSO3气体通入1L容积恒定的密闭容器中,维持容器内温度不变,5min末测得SO3的物质的量为0.4mol。则下列说法正确的是( )
2SO2(g)+O2(g),将1molSO3气体通入1L容积恒定的密闭容器中,维持容器内温度不变,5min末测得SO3的物质的量为0.4mol。则下列说法正确的是( )
A. 0~5min,O2的生成速率v(O2)=0.06mol·L-1·min-1
B. 若起始时充入3molSO3,起始时SO3分解速率不变
C. 若某时刻消耗了0.5molSO3同时生成了0.25molO2,则表明该反应达到了平衡状态
D. 达到平衡时,SO2和SO3的浓度相等
【答案】A
【解析】A、0-5min消耗的SO3的物质的量为(1-0.4)mol=0.6mol,产生O2的物质的量为0.6/2mol=0.3mol,根据化学反应速率的数学表达式,v(O2)=0.3/(1×5)mol/(L·min)=0.06mol/(L·min),故A正确;B、若起始时充入3molSO3,反应物浓度增大,化学反应速率加快,故B错误;C、消耗SO3,生成O2,反应都是向正反应方向进行,不能说明反应达到平衡,故C错误;D、根据题目中所给信息,无法判断SO2和SO3浓度是否相同,故D错误。

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案【题目】已知某条件下,合成氨反应的数据如下:N2(g)+3H2(g)2ΝΗ3(γ)
起始浓度/molL﹣1 | 1.0 | 3.0 | 0.2 |
2s末浓度/molL﹣1 | 0.6 | 1.8 | 1.0 |
4s末浓度/molL﹣1 | 0.4 | 1.2 | 1.4 |
当用氨气浓度的增加来表示该反应的速率时,下列说法中错误的是( )
A.2s末氨气的反应速率=0.4mol(Ls)﹣1
B.前2s时间内氨气的平均反应速率=0.4mol(Ls)﹣1
C.前4s时间内氨气的平均反应速率=0.3mol(Ls)﹣1
D.2~4s时间内氨气的平均反应速率=0.2mol(Ls)﹣1