题目内容
20.下列有关说法正确的是( )| A. | 常温下,向醋酸溶液中加入少量的水,溶液中c(H+)将增大 | |
| B. | 常温下,pH相同的NaOH溶液和Ba(OH)2溶液中,水的电离程度相同 | |
| C. | 向NaHCO3溶液中加入少量的澄清石灰水,所得溶液的pH不变 | |
| D. | 常温下,2NO(g)+2CO(g)═N2(g)+2CO(g)能自发进行,则该反应的△H>0 |
分析 A、加水对醋酸的电离起促进作用,氢离子的物质的量变大;
B、常温下,同浓度的氢离子和氢氧根离子对水的电离抑制程度相等;
C、向NaHCO3溶液中加入少量的澄清石灰水,有少量的碳酸氢钠转化为碳酸钠和碳酸钙,而碳酸钠的水解程度大于碳酸氢钠;
D、正反应为熵减的反应,根据△H-T△S=△G<0反应自发进行,据此判断.
解答 解:A、加水对醋酸的电离起促进作用,氢离子的物质的量变大,但溶液的体积变大,c(H+)将减少,故A错误;
B、常温下,同浓度的氢离子和氢氧根离子对水的电离抑制程度相等,而pH相同的NaOH溶液和Ba(OH)2溶液说明氢氧根离子浓度相等,所以水的电离程度相同,故B正确;
C、向NaHCO3溶液中加入少量的澄清石灰水,有少量的碳酸氢钠转化为碳酸钠和碳酸钙,而碳酸钠的水解程度大于碳酸氢钠,所以溶液的pH变大,故C错误;
D、正反应为熵减的反应,即△S<0,常温下能自发进行,根据△H-T△S=△G<0反应自发进行,可推知该反应△H<0,故D错误;
故选B.
点评 本题比较综合,是常见题型,涉及弱电解质的电离、影响电离平衡的因素、盐的水解影响因素和反应的自发性等,难度不大,侧重对基础知识的考查.

练习册系列答案
相关题目
9.下列叙述错误的是( )
| A. | 碱金属元素原子最外层都只有1个电子 | |
| B. | 依Li、Na、K、Rb,单质熔沸点升高,密度增大 | |
| C. | 单质氧化性:F2>Cl2>Br2>I2 | |
| D. | 氢化物稳定性:HF>HCl>HBr>HI |
10.某一化学反应在0.5L的密闭容器中,反应物B的物质的量在5s内从2.0mol变成0.5mol,在这5s内B的化学反应速率为( )
| A. | 3 mol/L | B. | 0.3molL/(L•s) | C. | 0.6 molL/(L•s) | D. | 0.1 molL/(L•s) |
15.兰州要建成资源节约型和生态保护型省份.下列措施或说法不正确的是( )
| A. | 使用太阳能热水器、沼气利用、玉米制乙醇等都涉及到生物质能的利用 | |
| B. | 用新的无害的汽油添加剂代替四乙基铅抗震剂以减少污染 | |
| C. | 火力发电用煤先进行脱硫处理,积极开发风能、生物质能发电 | |
| D. | 绿色化学要求利用化学原理从源头消除污染,期望在化学反应和化学工业过程中充分利用参与反应的原料,实现零排放 |
5.位于三个周期的短周期元素X、Y、Z、M、N的原子序数依次增大,又知Y原子的最外层电子数是其内层电子数的3倍,M原子的最外层上只有2个电子,Z与X位于同一主族,N与Y位于同一主族.下列叙述正确的是( )
| A. | 原子半径:r(Z)>r(M)>r(N)>r(Y)>r(X) | B. | 元素的负电性:Y>N>X>Z | ||
| C. | 元素的第一电离能:I1(M)>I1(Z)>I1(X) | D. | 原子中的为成对电子数:N>Y>Z>M |
12.某学生做葡萄糖的还原性实验,取4mL0.5mol/L的CuSO4溶液和4mL0.5mol/L的NaOH溶液,将它们混合后滴入1.0mL的10%的葡萄糖溶液,加热煮沸没有看到红色沉淀生成,这是因为( )
| A. | 葡萄糖浓度太浓 | B. | 加热时间不够 | C. | NaOH的量太少 | D. | CuSO4的量太少 |
9.下列反应的化学方程式或离子方程式书写正确的是( )
| A. | 氯乙烷中加入硝酸银溶液:Cl-+Ag+═AgCl↓ | |
| B. | 溴乙烷与氢氧化钠水溶液共热:CH3CH2Br+NaOH$→_{△}^{H_{2}O}$CH2═CH2↑+NaBr+H2O | |
| C. | 丙烯聚合:nCH2═CHCH3$→_{△}^{催化剂}$ | |
| D. | 苯酚钠溶液中通入少量二氧化碳: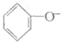 +CO2+H2O→ +CO2+H2O→ +HCO3- +HCO3- |
10.下列说法正确的是( )
| A. | 工业上可通过电解饱和食盐水制得金属钠 | |
| B. | 失去电子的物质是还原剂,还原剂发生氧化反应,表现出还原性 | |
| C. | 红热的铁丝在氯气中剧烈燃烧产生大量的白烟 | |
| D. | 干燥的氯气有漂白性,还能用作杀菌消毒剂 |
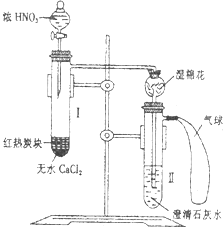 某校为了改进碳与HN03反应的实验,设计了如图所示的装置:先预热盛有无水CaCl2的试管I,然后投入几小块红热的炭块,再缓缓地向炭块上滴加浓HN03,反应即可连续进行.
某校为了改进碳与HN03反应的实验,设计了如图所示的装置:先预热盛有无水CaCl2的试管I,然后投入几小块红热的炭块,再缓缓地向炭块上滴加浓HN03,反应即可连续进行.