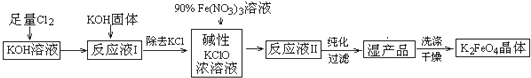
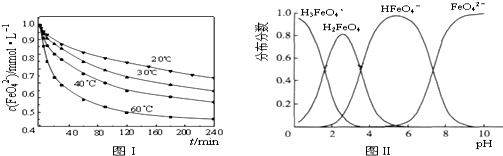
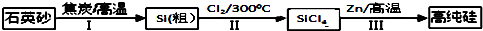题目内容
10.某一化学反应在0.5L的密闭容器中,反应物B的物质的量在5s内从2.0mol变成0.5mol,在这5s内B的化学反应速率为( )| A. | 3 mol/L | B. | 0.3molL/(L•s) | C. | 0.6 molL/(L•s) | D. | 0.1 molL/(L•s) |
分析 反应速率表示单位时间内浓度的变化量,即反应速率v=$\frac{△c}{△t}$,据此计算.
解答 解:反应速率表示单位时间内浓度的变化量,则5s内B的化学反应速率=$\frac{△c}{△t}$=$\frac{2.0mol-0.5mol}{0.5L•5s}$=0.6mol/L•s,
故选C.
点评 本题考查反应速率的计算,根据反应速率公式进行计算,注意纯液体、固体浓度一般认为是常数,其浓度在反应中不变.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
20.在1100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g)△H=a kJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是( )
| A. | 若生成1 mol Fe,则吸收的热量小于a kJ | |
| B. | 若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 | |
| C. | 若升高温度,正反应速率加快,逆反应速率减慢,则化学平衡正向移动 | |
| D. | 达到化学平衡状态时,若c(CO)=0.100 mol/L,则c(CO2)=0.0263 mol/L |
5.可逆反应N2+3H2?2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示.下列各关系中能说明反应已达到平衡状态的是( )
| A. | 3υ正(N2)=υ正(H2) | B. | υ正(N2)=υ逆(NH3) | C. | υ正(N2)=3υ逆(H2) | D. | 2υ正(H2)=3υ逆(NH3) |
15.用NA表示阿伏伽德罗常数的值,下列叙述中不正确的是( )
| A. | 分子总数为NA的NO2和CO2的混合气体中含有的氧原子数是2NA | |
| B. | 28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| C. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 常温常压下,22.4L氯气与足量镁粉充分反应后,转移的电子数为2NA |
20.下列有关说法正确的是( )
| A. | 常温下,向醋酸溶液中加入少量的水,溶液中c(H+)将增大 | |
| B. | 常温下,pH相同的NaOH溶液和Ba(OH)2溶液中,水的电离程度相同 | |
| C. | 向NaHCO3溶液中加入少量的澄清石灰水,所得溶液的pH不变 | |
| D. | 常温下,2NO(g)+2CO(g)═N2(g)+2CO(g)能自发进行,则该反应的△H>0 |
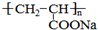 )是一种强吸水树脂.由某烃A合成聚丙烯酸钠的流程如图:
)是一种强吸水树脂.由某烃A合成聚丙烯酸钠的流程如图: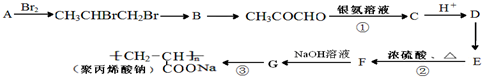
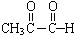 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$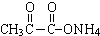 +3NH3+2Ag↓+H2O.
+3NH3+2Ag↓+H2O.