题目内容
5.位于三个周期的短周期元素X、Y、Z、M、N的原子序数依次增大,又知Y原子的最外层电子数是其内层电子数的3倍,M原子的最外层上只有2个电子,Z与X位于同一主族,N与Y位于同一主族.下列叙述正确的是( )| A. | 原子半径:r(Z)>r(M)>r(N)>r(Y)>r(X) | B. | 元素的负电性:Y>N>X>Z | ||
| C. | 元素的第一电离能:I1(M)>I1(Z)>I1(X) | D. | 原子中的为成对电子数:N>Y>Z>M |
分析 位于三个周期的短周期元素X、Y、Z、M、N的原子序数依次增大,Y原子的最外层电子数是其内层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故Y为O元素;
N与Y位于同一主族,则N为S元素;M原子的最外层上只有2个电子,原子序数大于氧,只能处于第三周期,故M为Mg;Z
与X位于同一主族,Z的原子序数小于Mg、大于氧,且X原子序数小于氧,只能处于IA族,故X为H元素、Z为Na,结合元素周期律解答.
解答 解:位于三个周期的短周期元素X、Y、Z、M、N的原子序数依次增大,Y原子的最外层电子数是其内层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故Y为O元素;N与Y位于同一主族,则N为S元素;M原子的最外层上只有2个电子,原子序数大于氧,只能处于第三周期,故M为Mg;Z与X位于同一主族,Z的原子序数小于Mg、大于氧,且X原子序数小于氧,只能处于IA族,故X为H元素、Z为Na.
A.所有元素中H原子半径最小,同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:Z(Na)>M(Mg)>N(S)>Y(O)>X(H),故A正确;
B.非金属性越强,元素电负性越大,故电负性Y(O)>N(S)>X(H)>Z(Na),故B正确;
C.非金属性越强,第一电离能越大,同周期自左而右第一电离能呈增大趋势,故第一电离能:H>Mg>Na,故C错误;
D.Y为O、Z为Na、M为Mg、N为S,原子中的为成对电子数分别为:2、1、0、2,故D错误,
故选AB.
点评 本题考查结构性质位置关系应用,侧重对元素周期律的考查,推断元素是解题关键,注意对元素周期律的理解掌握.

练习册系列答案
相关题目
14.现有部分短周期元素的性质或原子结构如下表:
(1)元素T的阴离子的结构示意图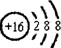 ;元素X的最高价氧化物的电子式
;元素X的最高价氧化物的电子式
(2)元素Y 在周期表中位于二周期,ⅤA族.该元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有离子键、共价键;
(3)四种元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式)
(4)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bce
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.Z的最高价氧化物所对应的水化物比T的最高价氧化物所对应的水化物的酸性强
d.Z的氢化物比T的氢化物溶解度大
e.Z的单质与H2化合比 T的单质与H2化合更容易
(5)含有34个电子的元素X的氢化物的分子式C4H10
(6)写出实验室制备Z单质的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(7)比较T和Z的简单离子的半径大小:S2->Cl-(用元素离子符号表示)
| 元素编号 | 元素性质或原子结构 |
| T | M层的电子数为K层电子数的3倍 |
| X | 其氢化物的空间构型为正四面体 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
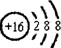 ;元素X的最高价氧化物的电子式
;元素X的最高价氧化物的电子式
(2)元素Y 在周期表中位于二周期,ⅤA族.该元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有离子键、共价键;
(3)四种元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式)
(4)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bce
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.Z的最高价氧化物所对应的水化物比T的最高价氧化物所对应的水化物的酸性强
d.Z的氢化物比T的氢化物溶解度大
e.Z的单质与H2化合比 T的单质与H2化合更容易
(5)含有34个电子的元素X的氢化物的分子式C4H10
(6)写出实验室制备Z单质的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(7)比较T和Z的简单离子的半径大小:S2->Cl-(用元素离子符号表示)
15.用NA表示阿伏伽德罗常数的值,下列叙述中不正确的是( )
| A. | 分子总数为NA的NO2和CO2的混合气体中含有的氧原子数是2NA | |
| B. | 28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| C. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 常温常压下,22.4L氯气与足量镁粉充分反应后,转移的电子数为2NA |
13.月季花适宜在酸性土壤中生长.某同学给月季花施肥前,对下列氮肥溶液的pH进行了测定,结果如下:
该同学最好选用( )
| 化肥名称 | 尿素 | 碳酸氢铵 | 硫酸铵 | 氨水 |
| 溶液的pH | 7 | 8 | 5 | 11 |
| A. | 碳酸氢铵 | B. | 尿素 | C. | 氨水 | D. | 硫酸铵 |
20.下列有关说法正确的是( )
| A. | 常温下,向醋酸溶液中加入少量的水,溶液中c(H+)将增大 | |
| B. | 常温下,pH相同的NaOH溶液和Ba(OH)2溶液中,水的电离程度相同 | |
| C. | 向NaHCO3溶液中加入少量的澄清石灰水,所得溶液的pH不变 | |
| D. | 常温下,2NO(g)+2CO(g)═N2(g)+2CO(g)能自发进行,则该反应的△H>0 |
10.将等质量的铜片在酒精灯上加热后,分别插入下列物质中,放置片刻,最终铜片质量减少的是( )
| A. | 盐酸 | B. | 无水乙醇 | C. | 石灰水 | D. | H2 |
17.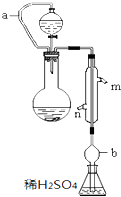 实验小组测定某肥料中的总氮含量(以氮的质量分数表示),实验装置如图(图中加热及夹持仪器略去).称取1.200g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在碱性溶液中蒸馏氨,用25.00mL浓度为0.5000mol•L-1硫酸溶液充分吸收,再用浓度为0.1000mol•L-1氢氧化钠溶液滴定未反应的硫酸.重复上述实验三次.实验数据如下:
实验小组测定某肥料中的总氮含量(以氮的质量分数表示),实验装置如图(图中加热及夹持仪器略去).称取1.200g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在碱性溶液中蒸馏氨,用25.00mL浓度为0.5000mol•L-1硫酸溶液充分吸收,再用浓度为0.1000mol•L-1氢氧化钠溶液滴定未反应的硫酸.重复上述实验三次.实验数据如下:
(1)写出圆底烧瓶内发生反应的离子方程式NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(2)分液漏斗和圆底烧瓶之间的导管a的作用是保证烧瓶和漏斗内压强恒定,有利于漏斗中的液体滴入锥形瓶中,b的作用是防止锥形瓶中的溶液倒吸.
(3)在滴定过程中,以下操作会使所测总氮含量偏小的是(填序号)BD.
A.锥形瓶水洗后未烘干 B.滴定过程中滴定管有漏水现象
C.滴定过程中有少量溶液从锥形瓶中溅出 D.滴定前滴定管内有气泡,滴定后没有了
(4)若实验操作均正确,但测定结果偏低,可能造成该结果的主要原因是仍有氨气残留在装置中未被锥形瓶中的硫酸吸收.
(5)利用题目中所给数据计算肥料中总氮含量为28.6%(计算结果保留到小数点后1位).
 实验小组测定某肥料中的总氮含量(以氮的质量分数表示),实验装置如图(图中加热及夹持仪器略去).称取1.200g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在碱性溶液中蒸馏氨,用25.00mL浓度为0.5000mol•L-1硫酸溶液充分吸收,再用浓度为0.1000mol•L-1氢氧化钠溶液滴定未反应的硫酸.重复上述实验三次.实验数据如下:
实验小组测定某肥料中的总氮含量(以氮的质量分数表示),实验装置如图(图中加热及夹持仪器略去).称取1.200g样品,通过化学方法将肥料中的氮转化成铵盐(除样品外,所加试剂均不含氮元素),然后在碱性溶液中蒸馏氨,用25.00mL浓度为0.5000mol•L-1硫酸溶液充分吸收,再用浓度为0.1000mol•L-1氢氧化钠溶液滴定未反应的硫酸.重复上述实验三次.实验数据如下:| 实验 次数 | 氢氧化钠溶液的体积 | |
| 滴定前刻度(mL) | 滴定后刻度(mL) | |
| 1 | 0.00 | 5.22 |
| 2 | 6.00 | 11.18 |
| 3 | 12.00 | 17.20 |
(2)分液漏斗和圆底烧瓶之间的导管a的作用是保证烧瓶和漏斗内压强恒定,有利于漏斗中的液体滴入锥形瓶中,b的作用是防止锥形瓶中的溶液倒吸.
(3)在滴定过程中,以下操作会使所测总氮含量偏小的是(填序号)BD.
A.锥形瓶水洗后未烘干 B.滴定过程中滴定管有漏水现象
C.滴定过程中有少量溶液从锥形瓶中溅出 D.滴定前滴定管内有气泡,滴定后没有了
(4)若实验操作均正确,但测定结果偏低,可能造成该结果的主要原因是仍有氨气残留在装置中未被锥形瓶中的硫酸吸收.
(5)利用题目中所给数据计算肥料中总氮含量为28.6%(计算结果保留到小数点后1位).
15.能影响水的电离平衡,并使溶液中c(H+)>c(OH-)的操作是( )
| A. | 向水中投入一小块金属钠 | B. | 将水加热煮沸 | ||
| C. | 向水中加入CH3COONa晶体 | D. | 向水中加入NH4Cl溶液 |
 .
.