题目内容
10.用NA表示阿伏加德罗常数,下列说法中正确的是( )| A. | 标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA | |
| B. | 18g D2O含有的电子数为10NA | |
| C. | 在标准状况下,22.4LSO3的物质的量为1mol | |
| D. | 同温、同压下,相同体积的氟气和氩气所含的原子数相等 |
分析 A.标况下11.2L气体的物质的量为0.5mol,0.5mol氧气和氮气的混合气体中含有1mol原子;
B.D2O分子中含有10个电子,18g重水的物质的量为0.9mol,含有0.9mol电子;
C.标准状况下SO3的状态不是气体;
D.根据稀有气体为单原子分子,氟气为双原子分子判断.
解答 解:A.标准状况下,11.2L氮气和氧气的混合物中含有0.5mol气体分子,含有1mol原子,所含的原子数为NA,故A正确;
B.18g D2O的物质的量为0.9mol,1mol重水中含有0.9mol电子,含有的电子数为0.9NA,故B错误;
C.标准状况下SO3的状态不是气体,不能使用标况下的气体摩尔体积计算其物质的量,故C错误;
D.同温、同压下,相同体积的氟气和氩气,二者物质的量相等,但是氟气为双原子分子,氩气为单原子分子,所以二者所含的原子数不相等,故D错误.
故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件,试题有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
20.下列状态下,不能导电的强电解质是( )
| A. | 冰醋酸 | B. | 纯硫酸 | C. | 蔗糖溶液 | D. | 氢氧化钠溶液 |
1.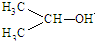 可简写为
可简写为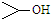 .达菲是世界卫生组织推荐的抗禽流感药物,其结构简式如图(
.达菲是世界卫生组织推荐的抗禽流感药物,其结构简式如图(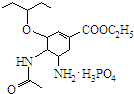 ),有关它的说法错误的是( )
),有关它的说法错误的是( )
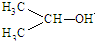 可简写为
可简写为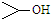 .达菲是世界卫生组织推荐的抗禽流感药物,其结构简式如图(
.达菲是世界卫生组织推荐的抗禽流感药物,其结构简式如图( ),有关它的说法错误的是( )
),有关它的说法错误的是( )| A. | 达菲是一种磷酸盐 | |
| B. | 达菲分子中含有肽键 | |
| C. | 达菲的分子式为C16H31N2O8P | |
| D. | 1mol达菲可与2mol H2发生加成反应 |
18.设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 28g N2、N2O、N2O4的混合气体含有氮原子数为2NA | |
| B. | 质量均为7.8 g Na2S、Na2O2的固体中含有的阴离子数均为0.1NA | |
| C. | 0.5 mol•L-1的乙酸溶液中,乙酸分子的数目小于0.5NA | |
| D. | 78g苯分子中含有碳碳双键数为3 NA |
5.常温下能用铁制或铝制容器盛放的是( )
| A. | 稀硝酸、稀硫酸 | B. | 硝酸银溶液 | C. | 浓硝酸、浓硫酸 | D. | 硫酸铜溶液 |
15.A、B、C、D、E为短周期元素,其原子序数依次增大.其中A的最外层电子数为其周期数的2倍;B和D为同主族元素,其中B的氢化物在常温下为液态;C的+1价离子比E的-1价离子少8个电子.则下列说法正确的是( )
| A. | D氢化物的稳定性比B氢化物的稳定性强 | |
| B. | 5种元素中,E元素氧化物的水合物的酸性最强 | |
| C. | A与B、D分别可形成AB2、AD2的化合物 | |
| D. | B和C可形成离子化合物,且C离子的半径大于B离子的半径 |
2.根据表中信息,判断下列叙述中正确的是( )
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeI2 | I2 | ||
| ② | KClO3 | 浓盐酸 | Cl2 | ||
| ③ | KMnO4 | H2O2 | O2 | Mn2+ |
| A. | 表中①组的反应中氧化产物一定是I2 | |
| B. | 氧化性强弱的比较:KClO3>Cl2>Fe3+>I2 | |
| C. | 表中②组每生成1molCl2,转移1mol电子 | |
| D. | 表中③组其他反应物可以为浓盐酸 |
19.对于化学反应A+B═C+D的下列说法中正确的是( )
| A. | 若生成物C和D分别为盐和水,则该反应一定是中和反应 | |
| B. | 若A和C是单质,B和D是化合物,则该反应一定是置换反应 | |
| C. | 若A是可溶性碱,B是可溶性盐,则C和D不可能是两种沉淀 | |
| D. | 若A是可溶性碱,B是可溶性盐,则C和D一定是另一种碱和另一种盐 |
10.某金属晶体的晶胞如图所示,下列有关说法中正确的是( )
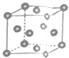

| A. | 只有金属钋原子采用这种堆积方式 | B. | 这种堆积方式中,配位数为8 | ||
| C. | 这是金属晶体的一种最密堆积方式 | D. | 这种堆积方式的空间利用率较低 |