题目内容
【题目】下列实验装置或操作与实验目的不相符的是
|
|
|
|
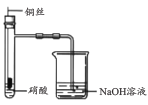
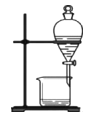
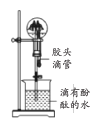
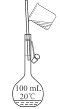
A. 证明铜与硝酸的反应 | B. 分离乙醇和乙酸的混合液 | C. 证明氨气易溶于水且水溶液呈碱性 | D. 配制100 mL0.100 mol/LNaCl溶液 |
A.AB.BC.CD.D
【答案】B
【解析】
A.铜与浓硝酸反应生成硝酸铜和NO2,铜与稀硝酸反应生成硝酸铜和NO,故观察到NaOH溶液冒气泡,试管中溶液变为蓝色,有红棕色气体产生或者有无色气体而后变为红棕色,则能证明铜与硝酸的反应,A不符合题意;
B.由于乙醇和乙酸能以任意比混合,故不能用分液的方法将混合液进行分离,B符合题意;
C.用氨气作喷泉实验,快速形成喷泉是由于氨气易溶于水,导致烧瓶中的压强快速减小,滴加酚酞后形成红色喷泉,则证明氨气的水溶液呈碱性,C不符合题意;
D. 配制100 mL0.100 mol/LNaCl溶液时,转移时为了防止液体滴落而溅出容量瓶外面,需用玻璃棒引流,D不符合题意;
答案为B。

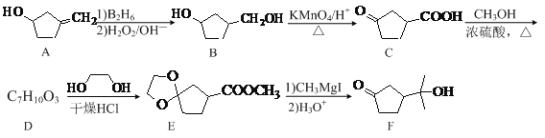
【题目】某学习小组探究稀HNO3、浓HNO3与铜的反应。
装置(尾气处理装置略) | 现象 |
| Ⅰ中开始无明显现象,渐有小气泡生成,越来越剧烈,液面上方出现浅红棕色气体,溶液呈蓝色。 |
Ⅱ中反应剧烈,迅速生成大量红棕色气体,溶液呈绿色。 |
(1)试管Ⅰ中Cu与稀HNO3反应的化学方程式是________。
(2)Ⅱ中反应的速率比Ⅰ中的快,原因是________。
(3)针对Ⅱ中溶液呈绿色的原因,提出假设:
假设1:Cu2+的浓度较大所致;

假设2:溶解了生成的NO2。
探究如下:取Ⅱ中绿色溶液,分为两等份。
①取一份于如图所示装置中,_______(填“操作”和“现象”),证实Ⅱ中溶解了NO2。
②向另一份溶液加入_____(填化学试剂),溶液变为蓝色。证实假设1不成立,假设2成立。
(4)对于稀HNO3与铜生成NO、浓HNO3与铜生成NO2的原因,提出两种解释:
解释1.HNO3浓度越稀,溶液中NO3-的数目越少,被还原时,每个NO3-从还原剂处获得较多电子的机会_____(填“增多”或“减少”),因此被还原为更低价态。
解释2.推测下列平衡导致了产物的不同,并通过如下实验证实了推测的合理性。
3NO2+H2O=2HNO3+NO

①B中盛放的试剂是________。
②C中盛放Cu(NO3)2和_________。
③该小组证实推测的合理性所依据的实验现象是________。