题目内容
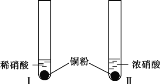
【题目】某学习小组探究稀HNO3、浓HNO3与铜的反应。
装置(尾气处理装置略) | 现象 |
| Ⅰ中开始无明显现象,渐有小气泡生成,越来越剧烈,液面上方出现浅红棕色气体,溶液呈蓝色。 |
Ⅱ中反应剧烈,迅速生成大量红棕色气体,溶液呈绿色。 |
(1)试管Ⅰ中Cu与稀HNO3反应的化学方程式是________。
(2)Ⅱ中反应的速率比Ⅰ中的快,原因是________。
(3)针对Ⅱ中溶液呈绿色的原因,提出假设:
假设1:Cu2+的浓度较大所致;
假设2:溶解了生成的NO2。
探究如下:取Ⅱ中绿色溶液,分为两等份。
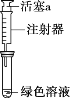
①取一份于如图所示装置中,_______(填“操作”和“现象”),证实Ⅱ中溶解了NO2。
②向另一份溶液加入_____(填化学试剂),溶液变为蓝色。证实假设1不成立,假设2成立。
(4)对于稀HNO3与铜生成NO、浓HNO3与铜生成NO2的原因,提出两种解释:
解释1.HNO3浓度越稀,溶液中NO3-的数目越少,被还原时,每个NO3-从还原剂处获得较多电子的机会_____(填“增多”或“减少”),因此被还原为更低价态。
解释2.推测下列平衡导致了产物的不同,并通过如下实验证实了推测的合理性。
3NO2+H2O=2HNO3+NO

①B中盛放的试剂是________。
②C中盛放Cu(NO3)2和_________。
③该小组证实推测的合理性所依据的实验现象是________。
【答案】3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O 硝酸浓度大 向上拉动活塞a,试管内液面上方出现红棕色气体 Cu(OH)2(或CuO等) 增多 水 浓硝酸 C中溶液变绿
【解析】
(一)Cu与硝酸反应,浓度不同,反应速率不同;稀硝酸反应后溶液呈蓝色,浓硝酸反应后溶液呈现绿色;若是由于NO2溶解所致,可通过减少NO2的含量,观察溶液颜色进行判断或通过增大溶液中Cu2+浓度,观察溶液颜色是否发生变化,判断导致原因是Cu2+浓度大小还是NO2的溶解;
(二)对于溶液颜色变化是否由NO3-浓度变化引起,可以根据NO3-浓度较小时溶液的颜色及浓度较大时溶液的颜色的异同作出判断。
(1)试管Ⅰ中Cu与稀HNO3反应产生硝酸铜、一氧化氮和水,反应的化学方程式是3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
(2)Ⅱ中是铜与浓硝酸反应,产生硝酸铜、二氧化氮和水,II中物质浓度大,反应速率快;
(3)①若溶液颜色差异是NO2溶解所致,则可以通过向上拉动活塞a,减小装置中NO2在溶液中的溶解度,就会看到试管内液面上方出现红棕色气体观察溶液的颜色是否变为蓝色;
②若向另一份溶液中加入含有Cu元素的物质,如CuO或Cu(OH)2,物质溶解,使溶液中Cu2+浓度增大,若溶液仍为蓝色。证实假设1不成立,假设2成立。
(4)解释1. HNO3浓度越稀,溶液中NO3-的数目越少,被还原时,每个NO3-从还原剂处获得较多电子的机会增多,被还原为较低的价态;
解释2.①Cu与浓硝酸反应产生NO2气体,NO2气体与B中水发生反应:3NO2+H2O=2HNO3+NO,将产生的NO气体通入到C溶液中,②C中含有较多NO3-离子,盛放Cu(NO3)2和浓硝酸,若C中溶液变为绿色,就证明解释1正确,否则2正确。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案【题目】如表是元素周期表的一部分,按要求填空
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)①元素的元素名称____________;⑩元素的元素符号_________________。
(2)在这些元素中,____________是最活泼的金属元素;_____________是最活泼的非金属元素;________是最不活泼的元素(用元素符号填写)。
(3)能形成气态氢化物.,且气态氢化物最稳定的是___________(用化学式填写)。
(4)这些元素的最高价氧化物对应水化物中的最强酸是_________;最强的碱是_________;具有两性的氢氧化物是________(用化学式填写)。
(5)从⑤到的元素中,____________原子半径最小(用元素符号填写)。
(6)比较⑤与⑥的化学性质,_________更活泼(用元素符号填写)
(7)用电子式表示④与⑥所组成物质的形成过程_______________,该化合物属于___________(填“共价”或“离子”)化合物。
(8)写出①与③形成的化合物的电子式_______、结构式为_______
(9)元素③与元素⑩相比,能证明这两种元素非金属性强弱的事实是_____(填选项序号)。
A.常温下③的单质和⑩的单质状态不同
B.③的简单氢化物比⑩的简单氢化物稳定
C.③的简单氢化物的沸点比⑩的简单氢化物的沸点高
D.③的单质能与⑩的简单氢化物反应生成⑩
【题目】溴主要以Br- 形式存在于海水(呈弱碱性)中,利用空气吹出法从海水中提溴,工艺流程示意如下。
![]()
资料:常温下溴呈液态,深红棕色,易挥发。
(1)酸化:将海水酸化的主要目的是避免_______(写离子反应方程式)。
(2)脱氯:除去含溴蒸气中残留的Cl2
①具有脱氯作用的离子是_______。
②溶液失去脱氯作用后,补加FeBr2或加入_______,脱氯作用恢复。
(3)富集、制取Br2:
用Na2CO3溶液吸收溴,Br2歧化为BrO3- 和Br-。再用H2SO4酸化歧化后的溶液得到Br2,其离子反应方程式为_______。
(4)探究(3)中所用H2SO4浓度对Br2生成的影响,实验如下:
序号 | A | B | C |
试剂组成 | 1 mol/L NaBr 20% H2SO4 | 1 mol/L NaBr 98% H2SO4 | 将B中反应后溶液用水稀释 |
实验现象 | 无明显现象 | 溶液呈棕红色,放热 | 溶液颜色变得很浅 |
①B中溶液呈棕红色说明产生了_______。
②分析C中溶液颜色变浅的原因,甲同学认为是发生了化学反应所致;乙同学认为是用水稀释所致。若认为甲同学的分析合理,请用具体的反应说明理由;若认为乙同学的分析合理,进一步设计实验方案说明。理由或方案:_______。
③酸化歧化后的溶液宜选用的酸是______(填“稀硫酸”或“浓硫酸”)。