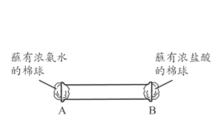
题目内容
【题目】利用自然资源制备相关化学物质,下列化学工艺不可行的是
A.提取食盐后母液![]() 含Br2的液体
含Br2的液体![]()
![]() 粗溴
粗溴![]() 纯溴
纯溴
B.石英砂![]() 粗硅
粗硅![]() 粗四氯化硅
粗四氯化硅![]() 高纯硅
高纯硅
C.FeS2![]() SO2
SO2![]() H2SO3
H2SO3![]() H2SO4
H2SO4
D.铝土矿![]() Na[Al(OH)4]溶液
Na[Al(OH)4]溶液![]() Al(OH)3
Al(OH)3![]() Al2O3
Al2O3![]() 铝
铝
【答案】C
【解析】
A.提取食盐后的母液中提取单质溴的过程,要知道母液中是溴离子,需要先用Cl2氧化,此工艺可行的,故A正确;
B.由石英砂先制粗硅,再用H2还原SiCl4得到Si,是工业上制高纯硅的流程,工艺可行的,故B正确;
C.应首先进行二氧化硫的催化氧化,然后用98.3%的硫酸吸收,此工艺不可行,故C错误;
D.工业上用铝土矿制铝的过程,每一步所加试剂必须过量,此工艺可行的,故D正确;
故答案为C。

 阅读快车系列答案
阅读快车系列答案【题目】下列实验装置或操作与实验目的不相符的是
|
|
|
|
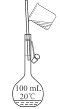
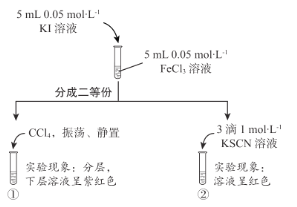
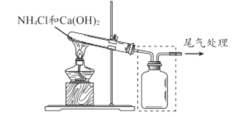
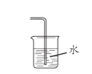
A. 证明铜与硝酸的反应 | B. 分离乙醇和乙酸的混合液 | C. 证明氨气易溶于水且水溶液呈碱性 | D. 配制100 mL0.100 mol/LNaCl溶液 |
A.AB.BC.CD.D
【题目】下列由电子排布式或排布图所得的结论错误的是( )
选项 | 电子排布式 | 结论 |
A | 1s22s22p | 违背洪特规则 |
B | 1s22s22p63s23p63d3 | 违背能量最低原理 |
C | N的电子排布图: | 违背泡利原理 |
D | 1s22s22p63s23p63d54s1 | 违背能量最低原理 |
A.AB.BC.CD.D
【题目】H2是一种重要的清洁能源。
(1)已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH2=-49.0kJ/mol,
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.1kJ/mol,H2还原CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g) ΔH1,则ΔH1=___kJ/mol,该反应自发进行的条件为_____。
CH3OH(g) ΔH1,则ΔH1=___kJ/mol,该反应自发进行的条件为_____。
A.高温 B.低温 C.任何温度条件下
(2)恒温恒压下,在容积可变的密闭容器中加入1molCO和2.2molH2,发生反应CO(g)+2H2(g)![]() CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。
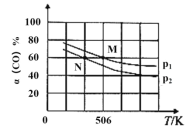
①压强:p1____p2。(填“>”<”或“=”)
②M点时,H2的转化率为_____(计算结果精确到0.1%), 该反应的平衡常数Kp=____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③下列各项能作为判断该反应达到平衡标志的是______(填字母);
A.容器内压强保持不变 B.2v正(H2)=v逆(CH3OH)
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
(3)H2还原NO的反应为2NO(g)+2H2(g)![]() N2(g)+2H2O(1),实验测得反应速率的表达式为v=kcm(NO)·cn(H2)(k是速率常数,只与温度有关)
N2(g)+2H2O(1),实验测得反应速率的表达式为v=kcm(NO)·cn(H2)(k是速率常数,只与温度有关)
①某温度下,反应速率与反应物浓度的变化关系如下表所示。
编号 | c(NO)/(mol/L) | c(H2)/(mol/L) | v/(mol·L-1·min-1) |
1 | 0.10 | 0.10 | 0.414 |
2 | 0.10 | 0.20 | 1.656 |
3 | 0.50 | 0.10 | 2.070 |
由表中数据可知,m=_____,n=_____。
②上述反应分两步进行:i.2NO(g)+H2(g)=N2(g)+H2O2(1)(慢反应);ii
A.H2O2是该反应的催化剂 B.反应i的活化能较高
C.总反应速率由反应ii的速率决定 D.反应i中NO和H2的碰撞仅部分有效
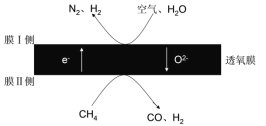
(4)2018年我国某科研团队利用透氧膜,一步即获得合成氨原料和合成液态燃料的原料。其工作原理如图所示(空气中N2与O2的物质的量之比按4:1计)。工作过程中,膜I侧所得![]() =3,则膜I侧的电极方程式为________。
=3,则膜I侧的电极方程式为________。