题目内容
16.一定温度下,在密闭容器中发生CaCO3(s)?CaO(s)+CO2(g)的反应,当反应达平衡时压缩容器体积,反应再次达到平衡时c(CO2)浓度将增大.正确(判断对错)分析 该反应中只有二氧化碳是气体,反应达到平衡后,压缩容器体积,二氧化碳浓度增大,虽然平衡逆向移动,根据勒夏特列移动原理分析.
解答 解:该反应中只有二氧化碳是气体,反应达到平衡后,压缩容器体积,二氧化碳浓度增大,虽然平衡逆向移动,根据勒夏特列移动原理,仅仅减弱二氧化碳浓度增大,但最终再次达到平衡时c(CO2)浓度将仍然增大,故答案为:正确.
点评 本题主要考查了平衡移动原理,主要勒夏特列移动原理的应用,难度不大.

练习册系列答案
相关题目
7.在催化剂、400℃时可实现氯的循环利用,如图是其能量关系图,下列分析正确的是( )

| A. | 曲线a是使用了催化剂的能量变化曲线 | |
| B. | 反应物的总键能高于生成物的总键能 | |
| C. | 反应的热化学方程式为:4HCl(g)+O2(g)$→_{400℃}^{催化剂}$2Cl2+2H2O(g)-115.6 kJ | |
| D. | 若反应生成2mol液态水,放出的热量高于115.6kJ |
4.下列叙述正确的是( )
| A. | 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和(a+1),则有c1=10c2. | |
| B. | 10mL0.1mol•L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中有c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 在0.1mol•L-1NaHSO3溶液中有c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3) | |
| D. | pH<7的某二元弱酸是酸式盐NaHA溶液中有c(H+)+2c(A2-)=c(OH-)+c(H2A) |
1.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1 molCaC2晶体中含有的离子总数为3NA | |
| B. | 常温常压下,3g-CH3中含有的电子数为1.8NA | |
| C. | NA个HCl分子与22.4LH2和Cl2的混合气体所含有的原子数均为2NA | |
| D. | 80 mL 12 mol/L的浓盐酸与足量MnO2反应,生成的Cl2分子数目为0.48 NA |
8.阿托酸乙酯可用于辅助胃肠道痉挛及溃疡.结构如图所示,下列说法正确的是( )
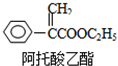

| A. | 能使高锰酸钾褪色,不能使溴水褪色 | |
| B. | 1mol阿托酸乙酯最多能与5mol H2加成 | |
| C. | 能发生加成、加聚、氧化、水解等反应 | |
| D. | 分子式为C11H13O2 |
2.某无色气体X可能含有氢气、一氧化碳、二氧化碳和甲烷四种气体中的一种或两种.为确认其组成,某同学取一定量该气体按下图所示装置进行实验(假设每步都充分反应或吸收),结果装置①中无明显变化,装置③增重1.8g,④中增重2.2g.下列关于气体X成分的分析中,错误的是( )
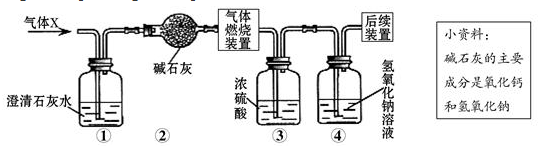

| A. | 一定没有二氧化碳 | B. | 可能含有甲烷和氢气 | ||
| C. | 可能只有甲烷 | D. | 可能含有氢气和一氧化碳 |
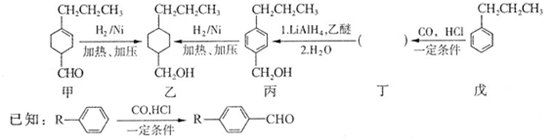
 和
和 生成(写结构简式).
生成(写结构简式). .
. +H2O$→_{△}^{NaOH}$
+H2O$→_{△}^{NaOH}$ +HCl或
+HCl或 按如图所示装置进行铁与水的反应实验,请回答下列问题:
按如图所示装置进行铁与水的反应实验,请回答下列问题: