题目内容
7.500mL NaNO3 和Cu(NO3)2混合溶液中c(NO3- )=6 mol/L,用石墨做电极电解此溶液,当通电一段时间后,两极均收集到气体22.4L(标准状况下),假定电解后溶液体积仍为500mL,下列说法正确的是( )| A. | 原混合溶液中c(Na+ )=6mol/L | B. | 电解后溶液中c(H+)=4mol/L | ||
| C. | 上述电解过程中共转移8mol电子 | D. | 电解后得到的Cu的物质的量为2mol |
分析 石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),
则阴极发生Cu2++2e-═Cu、2H++2e-═H2↑,
阳极发生4OH--4e-═O2↑+2H2O,
n(O2)=$\frac{22.4L}{22.4L/mol}$=1mol,结合电子守恒及物质的量浓度的计算来解答.
解答 解:石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),n(O2)=$\frac{22.4L}{22.4L/mol}$=1mol,
阳极发生4OH--4e-═O2↑+2H2O,
4mol 1mol
阴极发生Cu2++2e-═Cu、2H++2e-═H2↑,
1mol 2mol 1mol 2mol 1mol
A.c(Cu2+)=$\frac{1mol}{0.5L}$=2mol/L,由电荷守恒可知,原混合溶液中c(Na+)为6mol/L-2mol/L×2=2mol/L,故A错误;
B.电解后溶液中c(H+)为$\frac{4mol-2mol}{0.5L}$=4mol/L,故B正确;
C.由上述分析可知,电解过程中转移电子总数为4NA,故C错误;
D.电解得到的Cu的物质的量为1mol,故D错误;
故选B.
点评 本题考查电解原理,明确发生的电极反应及电子守恒是解答本题的关键,题目难度中等,选项D为学生解答的难点,注意氢氧根离子与氢离子的关系即可解答.

练习册系列答案
相关题目
17.请以FeSO4溶液、KI溶液、氯水为试剂探究Fe2+和I-的还原性强弱.
①提出假设:假设1:Fe2+还原性强于I-;假设2:I-还原性强于Fe2+
②设计实验方案,写出实验步骤、预期现象和结论.其他限选试剂:3mol•L-1 H2SO4、0.01mol•L-1KMnO4、20% KSCN、3%H2O2、淀粉溶液、紫色石蕊溶液.
①提出假设:假设1:Fe2+还原性强于I-;假设2:I-还原性强于Fe2+
②设计实验方案,写出实验步骤、预期现象和结论.其他限选试剂:3mol•L-1 H2SO4、0.01mol•L-1KMnO4、20% KSCN、3%H2O2、淀粉溶液、紫色石蕊溶液.
| 实 实验步骤 | 预期现象与结论 |
| 步步骤1:取2mLFeSO4溶液和2mLKI溶液混合于试管中,再滴加再滴加几滴氯水. | 溶 溶液变成黄色,推测有Fe3+或I2生成. |
| 步骤2:向试管中继续滴加几滴20%KSCN溶液或向试管中继续滴加几滴淀粉溶液 | 溶液不变红,说明I-的还原性强于Fe2+或溶液变蓝,说明I-的还原性强于Fe2+ |
18.下列除杂方法可行的是( )
| A. | 用过量氨水除去AlCl3溶液中的FeCl3 | |
| B. | 用饱和Na2CO3溶液除去CO2中HCl | |
| C. | 用Br2除去KBr溶液中的KCl | |
| D. | 用CuO除去CuCl2中的FeCl3 |
15.有①纤维素;②环己烷;③苯;④乙酸;取等质量的上述有机物分别在过量氧气中完全燃烧,其中耗氧量由大到小排列顺序正确的是( )
| A. | ①②③④ | B. | ②③①④ | C. | ④①③② | D. | ③④①② |
12.下列排列顺序正确的是( )
| A. | 熔沸点:H2O>HF>HCl | B. | 原子半径:Mg>Na>O | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 热稳定性:H2O>HF>H2S |
18.下列说法正确的是( )


| A. | 按系统命名法命名时,(图1)化合物的名称是2,4,6-三甲基-3-乙基庚烷 | |
| B. | 有机物(图2)的一种芳香族同分异构体能发生银镜反应 | |
| C. | 高分子化合物(图3),其单体为对苯二甲酸和乙醇 | |
| D. | 前期在西非国家爆发的埃博拉疫情极具蔓延之势,已知该病毒对化学药品敏感.乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
19.下列说法正确的是( )
| A. | 自然界中含有大量的游离态的硅,纯净的硅晶体可用于制作计算机芯片 | |
| B. | 工业上通常用电解钠、镁、铝对应的氯化物制得该三种金属单质 | |
| C. | Si、P、S、Cl相应的氢化物的还原性依次增强 | |
| D. | 测定相同条件下NaHCO3溶液和Na2SO4溶液的pH,判断碳与硫的非金属性强弱 |
 ;
;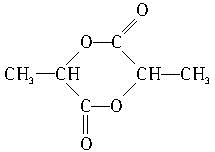 .
.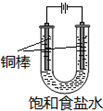 CuCl是应用广泛的有机合成催化剂,可采取不同方法制取.
CuCl是应用广泛的有机合成催化剂,可采取不同方法制取. [CuCl3]2-(无色溶液)逆向移动,生成CuCl.
[CuCl3]2-(无色溶液)逆向移动,生成CuCl.