题目内容
17.请以FeSO4溶液、KI溶液、氯水为试剂探究Fe2+和I-的还原性强弱.①提出假设:假设1:Fe2+还原性强于I-;假设2:I-还原性强于Fe2+
②设计实验方案,写出实验步骤、预期现象和结论.其他限选试剂:3mol•L-1 H2SO4、0.01mol•L-1KMnO4、20% KSCN、3%H2O2、淀粉溶液、紫色石蕊溶液.
| 实 实验步骤 | 预期现象与结论 |
| 步步骤1:取2mLFeSO4溶液和2mLKI溶液混合于试管中,再滴加再滴加几滴氯水. | 溶 溶液变成黄色,推测有Fe3+或I2生成. |
| 步骤2:向试管中继续滴加几滴20%KSCN溶液或向试管中继续滴加几滴淀粉溶液 | 溶液不变红,说明I-的还原性强于Fe2+或溶液变蓝,说明I-的还原性强于Fe2+ |
分析 ①Fe2+还原性强于I-或Fe2+还原性弱于I-;
②向KI溶液中滴加氯水,溶液由无色变成黄色,向FeSO4溶液中滴加氯水,溶液由浅绿色也变成黄色;步骤2可以用淀粉溶液检验碘单质的存在,也可以用KSCN溶液检验铁离子的存在.
解答 解:①假设1:Fe2+还原性强于I-;假设2:I-还原性强于Fe2+;
故答案为:I-还原性强于Fe2+;
②步骤2:可以用淀粉溶液检验碘单质的存在,溶液变蓝,证明I-的还原性强于Fe2+,也可以用20%KSCN溶液检验铁离子的存在,向试管中继续滴加几滴KSCN溶液,若溶液不变红,也说明I-的还原性强于Fe2+,
故答案为:向试管中继续滴加几滴20%KSCN溶液或向试管中继续滴加几滴淀粉溶液;溶液不变红,说明I-的还原性强于Fe2+或溶液变蓝,说明I-的还原性强于Fe2+.
点评 本题考查性质实验方案的设计及离子反应,把握现象与发生的氧化还原反应为解答的关键,侧重分析能力与实验能力的考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
7.下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).则下列有关Y的意义的叙述正确的是 ( )
| A. | 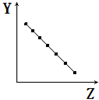 表示第三周期元素的原子半径(稀有气体除外) | |
| B. | 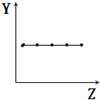 表示ⅡA族元素的最外层电子数 | |
| C. | 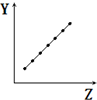 表示第二周期元素的电负性(稀有气体除外) | |
| D. | 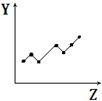 表示第三周期元素的第一电离能(稀有气体除外) | |
| E. | 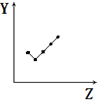 表示第ⅦA族元素氢化物的沸点. |
8.在一固定体积的密闭容器中,在850℃时发生如下反应:CO(g)+H2O(g)$\stackrel{催化剂}{?}$CO2(g)+H2(g),容器内各物质的浓度(mol/L)变化如下(在850℃时其化学平衡常数K=1.0).
(1)下列可以作为判断该反应已经达到化学平衡状态依据的是C.
A.容器内压强不变
B.CO的消耗速率等于CO2的生成速率
C.混合气体中CO的体积分数不变
D.c(CO2):c(H2)=1:l
(2)上表中:cl=0.08mol/L.
| 时间/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
A.容器内压强不变
B.CO的消耗速率等于CO2的生成速率
C.混合气体中CO的体积分数不变
D.c(CO2):c(H2)=1:l
(2)上表中:cl=0.08mol/L.
5.下列哪一种方法能证明一种无色液体是纯净的水( )
| A. | 测得这种液体的pH值等于7 | |
| B. | 在1.01×105Pa的压强下测得其沸点为373K | |
| C. | 电解这种液体,在阴极得到的气体体积为阳极气体体积的两倍 | |
| D. | 测得该液体不导电 |
12.下列各组离子:
(1)K+、Fe2+、SO42-、ClO- (2)K+、Al3+、Cl-、HCO3-
(3)ClO-、Cl-、K+、OH- (4)Fe3+、Cu2+、SO42-、Cl-
(5)Na+、K+、AlO2-、HCO3- (6)Ca2+、Na+、SO42-、CO32-
在水溶液中能大量共存的是( )
(1)K+、Fe2+、SO42-、ClO- (2)K+、Al3+、Cl-、HCO3-
(3)ClO-、Cl-、K+、OH- (4)Fe3+、Cu2+、SO42-、Cl-
(5)Na+、K+、AlO2-、HCO3- (6)Ca2+、Na+、SO42-、CO32-
在水溶液中能大量共存的是( )
| A. | (1)和(6) | B. | (3)和(4) | C. | (2)和(5) | D. | (1)和(4) |
6.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 5.6 g铁与足量氯气完全反应转移的电子数为0.2NA | |
| B. | 100 mL 2.0 mol•L-1的盐酸与醋酸溶液中氢离子均为0.2NA | |
| C. | 标准状况下,22.4 L CO2与22.4 L H2O所含原子数均为3 NA | |
| D. | 体积分别为1.0L pH=2的盐酸与硫酸溶液中氢离子数均为0.01NA |
7.500mL NaNO3 和Cu(NO3)2混合溶液中c(NO3- )=6 mol/L,用石墨做电极电解此溶液,当通电一段时间后,两极均收集到气体22.4L(标准状况下),假定电解后溶液体积仍为500mL,下列说法正确的是( )
| A. | 原混合溶液中c(Na+ )=6mol/L | B. | 电解后溶液中c(H+)=4mol/L | ||
| C. | 上述电解过程中共转移8mol电子 | D. | 电解后得到的Cu的物质的量为2mol |
