题目内容
6.用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率.工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)$\stackrel{高温}{?}$Si3N4(s)+12HCl(g)△H<0完成下列填空:(1)在一定温度下进行上述反应,若反应容器的容积为2L,3min后达到平衡,测得固体的质量增加了2.80g,则H2的平均反应速率0.02 mol/(L•min);该反应的平衡常数表达式K=$\frac{{c}^{12}(HCl)}{{c}^{3}(SiC{l}_{4})•{c}^{2}({N}_{2})•{c}^{6}({H}_{2})}$.
(2)上述反应达到平衡后,下列说法正确的是bd.
a.其他条件不变,压强增大,平衡常数K减小
b.其他条件不变,温度升高,平衡常数K减小
c.其他条件不变,增大Si3N4物质的量平衡向左移动
d.其他条件不变,增大HCl物质的量平衡向左移动
(3)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是ac.
a.3v逆(N2)=v正(H2) b.v正(HCl)=4v正(SiCl4)
c.混合气体密度保持不变 d.c(N2):c(H2):c(HCl)=1:3:6
(4)若平衡时H2和HCl的物质的量之比为m/n,保持其它条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比< m/n(填“>”、“=”或“<”).
分析 (1)固体的质量增加了2.80g为Si3N4的质量,根据n=$\frac{m}{M}$计算其物质的量,根据方程式计算消耗氢气的物质的量,再根据v=$\frac{\frac{△n}{V}}{△t}$计算v(H2);
平衡常数为生成物浓度化学计量数次数幂之积与生成物浓度化学计量数次数幂之积的比值;
(2)a.平衡常数只受温度影响;
b.正反应为放热反应,升高温度平衡向逆反应方向移动,平衡常数减小;
c.Si3N4是固体,增大其物质的量,不影响平衡移动;
d.增大HCl物质的量,平衡向消耗HCl的方向移动;
(3)a.根据速率之比对化学计量数之比,可以确定v正(H2)=v逆(H2);
b.都表示正反应速率,反应自始至终都成立;
c.混合气体密度保持不变说明混合气体的总质量不变,而平衡移动则气体的质量发生变化;
d.平衡时浓度关系与起始浓度有关、与转化率有关;
(4)该反应正反应是放热反应,降低温度,平衡向正反应移动,到达新平衡,H2的物质的量减小,HCl的物质的量物质的量增大.
解答 解:(1)固体的质量增加了2.80g为Si3N4的质量,其物质的量$\frac{2.8g}{140g/mol}$=0.02mol,根据方程式可知消耗氢气的物质的量=0.02mol×6=0.12mol,故v(H2)=$\frac{\frac{0.12mol}{2L}}{3min}$=0.02mol/(L.min);
平衡常数为生成物浓度化学计量数次数幂之积与生成物浓度化学计量数次数幂之积的比值,故该反应平衡常数K=$\frac{{c}^{12}(HCl)}{{c}^{3}(SiC{l}_{4})•{c}^{2}({N}_{2})•{c}^{6}({H}_{2})}$,
故答案为:0.02;$\frac{{c}^{12}(HCl)}{{c}^{3}(SiC{l}_{4})•{c}^{2}({N}_{2})•{c}^{6}({H}_{2})}$;
(2)a.平衡常数只受温度影响,压强增大,平衡常数K不变,故a错误;
b.正反应为放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,故b正确;
c.Si3N4是固体,增大其物质的量,不影响平衡移动,故c错误;
d.增大HCl物质的量,平衡向消耗HCl的方向移动,即向逆反应方向移动,故d正确,
故答案为:bd;
(3)a.根据速率之比对化学计量数之比,可以确定v正(H2)=v逆(H2),说明反应到达平衡状态,故a正确;
b.都表示正反应速率,反应自始至终都成立,不能说明到达平衡状态,故b错误;
c.混合气体密度保持不变说明混合气体的总质量不变,而平衡移动则气体的质量发生变化,可以说明到达平衡状态,故c正确;
d.平衡时浓度关系与起始浓度有关、与转化率有关,不能说明到达平衡状态,故D错误,
故答案为:ac;
(4)该反应正反应是放热反应,降低温度,平衡向正反应移动,到达新平衡,H2的物质的量减小,HCl的物质的量物质的量增大,新平衡H2和HCl的物质的量之比<$\frac{m}{n}$,
故答案为:<.
点评 本题考查化学反应速率计算、平衡状态判断、化学平衡移动等,意在考查学生的思维能力和分析推理能力,难度中等.

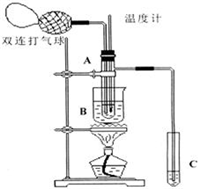 乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
(1)试管A内在60~80℃时发生的主要反应的化学方程式为(注明反应条件)2CH3CHO+O2$→_{CuO}^{60℃-80℃}$2CH3COOH;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A的反应液中;目的是测量反应溶液的温度;当试管A内的主要反应完成后温度计水银球的位置应在试管A的支管口处,目的是收集含乙酸的馏分;
(3)烧杯B的作用是使试管A内的反应液均匀受热发生反应,使生成的乙酸变成蒸气进入试管C;烧杯B内盛装的液体可以是乙二醇(甘油)(写出一种即可,在题给物质中找);
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案.所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末.实验仪器任选.该方案为:
将少量碳酸氢钠粉未,放入一个洁净的试管中,加入少量试管C中的液体,若有气体产生,则说明试管C中含有产物乙酸(或把一块pH试纸放在表面皿(或玻璃片)上,用洁净、干燥的玻璃棒蘸取试管C内的液体,点在pH试纸中部,试纸变色后,用标准比色卡比较来确定溶液的pH,进而说明是否有乙酸生成).
| A. |  转移溶液 | B. |  制蒸馏水 | C. |  分离水和酒精 | D. |  稀释浓硫酸 |
| A. | 若1mL PH=1盐酸与100mL MaOH溶液混合后,溶液PH=7,则NaOH溶液的PH=11 | |
| B. | 在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液的PH<7 | |
| C. | 某醋酸溶液的PH=a,将此溶液稀释1倍后,溶液的PH=b,则a>b | |
| D. | 1.0×10-3mol/L盐酸的PH=3.0,1.0×10-8mol/L盐酸PH=8.0 |
| A. | 75% | B. | 13.6% | C. | 14% | D. | 25% |
| A. | 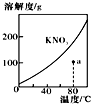 表示KNO3的溶解度曲线,a点所示的溶液是80℃时KNO3不饱和溶液 | |
| B. |  表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| C. |  表示0.1000mol/LNaOH滴定20.00 mL 0.1000mol/L醋酸的滴定曲线 | |
| D. | 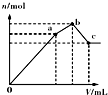 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,体积V与沉淀n的变化 |

| A. | 实验①制取的氨气溶解在饱和NaCl溶液 | |
| B. | 实验②通过观察右边试管有无倒吸现象说明铁钉是否发生吸氧腐蚀 | |
| C. | 实验③可用于证明碳的非金属性比硅强 | |
| D. | 图④是实验室洗涤胶头滴管的操作 |
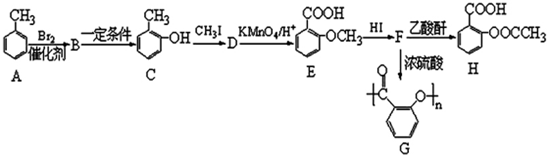
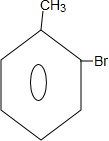 ;B→C的反应类型是取代反应.
;B→C的反应类型是取代反应.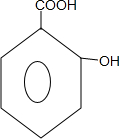 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$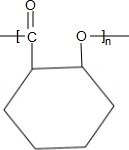 +nH2O.
+nH2O.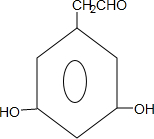 、
、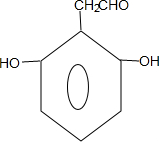 .
.