题目内容
18.经测定乙烯溶解在乙醇中形成的溶液中,氧的质量分数为8%,则此溶液中氢的质量分数为( )| A. | 75% | B. | 13.6% | C. | 14% | D. | 25% |
分析 乙醇的分子式为C2H6O,改写为C2H4.H2O,乙烯的乙醇溶液可以看作C2H4、H2O的混合物,根据氧元素质量分数计算水的质量分数,再计算C2H4的质量分数,进而计算碳元素质量分数,氢元素质量分数=1-w(C)-w(O).
解答 解:乙醇的分子式为C2H6O,改写为C2H4.H2O,乙烯的乙醇溶液可以看作C2H4、H2O的混合物,氧的质量分数为8%,则水的质量分数为$\frac{8%}{\frac{16}{18}}$=9%,C2H4的质量分数为1-9%=91%,碳元素质量分数为91%×$\frac{24}{28}$=78%,氢元素质量分数=1-w(C)-w(O)=1-78%-8%=14%,
故选C.
点评 本题考查质量分数计算,关键是利用改写法构造出碳元素、氧元素分别与部分氢元素质量定比关系,侧重考查学生分析计算能力.

练习册系列答案
相关题目
9.已知Rn-离子的质量数为35,中子数为18,核外电子总数为18,则该离子是( )
| A. | Cl- | B. | F - | C. | S2- | D. | Br |
13.水是一种廉价而且非常有用的试剂,下列用水就能鉴别的一组物质是( )
| A. | 苯、乙醇、四氯化碳 | B. | 苯、溴苯、四氯化碳 | ||
| C. | 硝基苯、乙醇、四氯化碳 | D. | 硝基苯、乙醇、乙酸 |
3.要证明CuSO4溶液显蓝色不是由于SO42-离子造成的,下列实验无意义的是( )
| A. | 观察K2SO4溶液的颜色 | |
| B. | 向CuSO4溶液中滴加适量的NaOH溶液,振荡后静置,溶液颜色消失 | |
| C. | 加水稀释后CuSO4溶液颜色变浅 | |
| D. | 向CuSO4溶液中滴加适量的Ba(NO3)2溶液,振荡后静置,溶液颜色未消失 |
10.分类是学习和研究化学的一种重要方法,下列分类合理的是( )
| A. | Na2O和Na2O2都属于碱性氧化物 | B. | KOH和Na2CO3都属于碱 | ||
| C. | NaHSO4和HNO3都属于酸 | D. | Na2O和SiO2都属于氧化物 |
8.在硫化钠水溶液中存在着多种离子和分子,下列关系式正确的是( )
| A. | c(S2-)+c(HS-)+c(H2S)+c(H+)=c(OH-) | B. | c(OH-)=c(HS-)+c(H+)+2 c(H2S) | ||
| C. | c(Na+)=c(S2-)+c(HS-)+c(H2S) | D. | c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) |
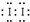 (用电子式表示).
(用电子式表示).