题目内容
15.下列图示与对应的叙述不相符的是( )| A. | 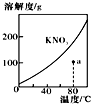 表示KNO3的溶解度曲线,a点所示的溶液是80℃时KNO3不饱和溶液 | |
| B. |  表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| C. |  表示0.1000mol/LNaOH滴定20.00 mL 0.1000mol/L醋酸的滴定曲线 | |
| D. | 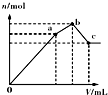 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,体积V与沉淀n的变化 |
分析 A、溶解度曲线上的点是饱和溶液,曲线以下的点是不饱和溶液来分析;
B、放热反应,反应物的总能量大于生成物的总能量,反应中加入催化剂会降低活化能,改变反应的速率,但反应热不改变;
C、醋酸为弱酸,没有滴入氢氧化钠溶液时,0.1000mol/L的醋酸溶液的pH大于1;
D、开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3?H2O,所以沉淀质量继续增加;继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O.
解答 解:A、溶解度曲线上的点是饱和溶液,曲线以下的a点是不饱和溶液,A正确,故A不选;
B、放热反应,反应物的总能量大于生成物的总能量,反应中加入催化剂会降低活化能,加快反应的速率,和图符合,故B不选;
C、0.1000mol•L-1NaOH溶液滴定20.00mL 0.1000mol•L-1CH3COOH溶液,消氢氧化钠溶液体积为0时,醋酸为弱电解质,醋酸溶液的pH大于1,图象中醋酸的pH=1与实际不符,故C选;
D、开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al(OH)3↓,再滴加Ba(OH)2,生成BaSO4沉淀,发生反应为SO42-+Ba2+=BaSO4↓,NH4++OH-=NH3?H2O,所以沉淀质量继续增加,但增加幅度较前一过程小;当SO42-完全沉淀时,继续滴加Ba(OH)2,Al(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,此时溶液为氨水与偏铝酸钡溶液,与图相符,故D不选.
故选C.
点评 本题以图象题的形式呈现来考查知识点,做题时要注意从图象中获取正确信息,正确判断得出结论.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 元素代号 | A | B | C | D | E | F | G | H |
| 化合价 | -1 | -2 | +4、-4 | +7、-1 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | A的单质能从GD2溶液中置换出D单质 | |
| B. | G在CB2中燃烧生成两种化合物 | |
| C. | E元素的单质不存在同素异形体 | |
| D. | A、F、H的离子半径由大到小顺序是A>H>F |
| A. | 观察K2SO4溶液的颜色 | |
| B. | 向CuSO4溶液中滴加适量的NaOH溶液,振荡后静置,溶液颜色消失 | |
| C. | 加水稀释后CuSO4溶液颜色变浅 | |
| D. | 向CuSO4溶液中滴加适量的Ba(NO3)2溶液,振荡后静置,溶液颜色未消失 |
| A. | Na2O和Na2O2都属于碱性氧化物 | B. | KOH和Na2CO3都属于碱 | ||
| C. | NaHSO4和HNO3都属于酸 | D. | Na2O和SiO2都属于氧化物 |
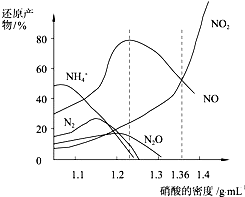
| A. | 密度小于1.1g/mL的硝酸与金属反应,还原产物主要是NH4+ | |
| B. | 当硝酸溶液的密度为1.36g/mL时,Fe与过量硝酸反应的化学方程式为:4Fe+18HNO3=4Fe(NO3)3+3NO+3NO2+9H2O | |
| C. | 稀硝酸与金属反应,一定被还原成NO | |
| D. | 某硝酸试剂瓶的标签注明:密度1.26g/mL,质量分数50.0%;若取该试剂10mL配成1000mL溶液,所得溶液的物质的量浓度为1 mol/L |
| A. | 酸性:H2SO4>H3PO4 | B. | 非金属性:O>S | ||
| C. | 碱性:NaOH>Mg(OH)2 | D. | 沸点:HF>HCl |

| A. | 该物质属于烃类 | B. | 该物质易溶于水 | ||
| C. | 该物质能使酸性高锰酸钾溶液褪色 | D. | 该物质是一种高分子化合物 |