题目内容
11.常温时下列叙述正确的是( )| A. | 若1mL PH=1盐酸与100mL MaOH溶液混合后,溶液PH=7,则NaOH溶液的PH=11 | |
| B. | 在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液的PH<7 | |
| C. | 某醋酸溶液的PH=a,将此溶液稀释1倍后,溶液的PH=b,则a>b | |
| D. | 1.0×10-3mol/L盐酸的PH=3.0,1.0×10-8mol/L盐酸PH=8.0 |
分析 A.根据酸碱混合及溶液的pH=7来分析NaOH溶液的pH;
B.根据离子对氨水的电离平衡的影响来分析平衡移动及溶液的pH;
C.根据弱电解质的电离平衡来分析稀释后的pH;
D.根据常温下酸溶液的pH一定小于7来分析.
解答 解:A.因酸碱混合后pH=7,即恰好完全反应,设碱的浓度为c,则1×0.1mol/L=100×c,c=0.001mol/L,则NaOH溶液的pH=11,故A正确;
B.在氨水中存在电离平衡,当加入NH4Cl,平衡逆向移动,氢氧根离子的浓度减小,由酚酞的变色范围8.2~10可知,此时溶液的pH可能小于8.2,不一定小于7,故B错误;
C.因醋酸是弱电解质,稀释时促进电离,但氢离子的浓度减小,则pH变大,即b>a,故C错误;
D.因常温下,中性溶液的pH=7,则酸的pH一定小于7,即盐酸溶液的pH不会为8,故D错误;
故选A.
点评 本题考查了电离平衡及pH的有关计算,学生应注意酸的溶液的pH在常温下一定小于7,能利用影响平衡的因素及酸碱反应的实质来分析解答即可,题目难度中等.

练习册系列答案
相关题目
2.根据如图信息,下列说法正确的是( )
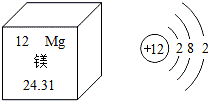

| A. | 镁原子的核电荷数为12 | |
| B. | 镁原子的相对原子质量为24.31g | |
| C. | 镁属于非金属元素 | |
| D. | 在化学反应中,镁原子容易得到电子 |
19.120℃时,将0.1mol某气态烃在足量的氧气中完全燃烧,测得反应前后气体体积相等,则该气态烃可能
( )
( )
| A. | 乙烷 | B. | 乙烯 | C. | 丙烷 | D. | 苯 |
16.若要检验酒精中是否含有少量水,可选用的试剂是M.制取无水酒精时,通常需向工业酒精中加入物质N,并加热蒸馏.则M、N分别应是( )
| A. | 生石灰、无水硫酸铜 | B. | 无水硫酸铜、浓硫酸 | ||
| C. | 无水硫酸铜、生石灰 | D. | 金属钠、生石灰 |
3.要证明CuSO4溶液显蓝色不是由于SO42-离子造成的,下列实验无意义的是( )
| A. | 观察K2SO4溶液的颜色 | |
| B. | 向CuSO4溶液中滴加适量的NaOH溶液,振荡后静置,溶液颜色消失 | |
| C. | 加水稀释后CuSO4溶液颜色变浅 | |
| D. | 向CuSO4溶液中滴加适量的Ba(NO3)2溶液,振荡后静置,溶液颜色未消失 |
20.金属与不同浓度的硝酸反应时,往往生成多种不同价态的还原产物.图d是各种不同密度的硝酸与铁反应时(相同温度)还原产物的分布图.下列说法不正确的是( )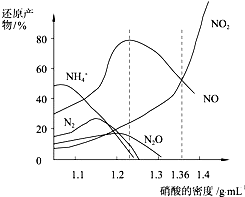

| A. | 密度小于1.1g/mL的硝酸与金属反应,还原产物主要是NH4+ | |
| B. | 当硝酸溶液的密度为1.36g/mL时,Fe与过量硝酸反应的化学方程式为:4Fe+18HNO3=4Fe(NO3)3+3NO+3NO2+9H2O | |
| C. | 稀硝酸与金属反应,一定被还原成NO | |
| D. | 某硝酸试剂瓶的标签注明:密度1.26g/mL,质量分数50.0%;若取该试剂10mL配成1000mL溶液,所得溶液的物质的量浓度为1 mol/L |
1.下列说法正确的是( )
| A. | 油脂发生皂化反应能生成甘油 | |
| B. | 蔗糖水解前后均可发生银镜反应 | |
| C. | Fe、Cu、Ag三种金属常用化学还原剂还原法制得 | |
| D. | 向蛋白质溶液中加入CuSO4溶液发生盐析 |