题目内容
反应A+B→C(△H>0)分两步进行:①A+B→X(△H<0),②X→C(△H>0)。下列示意图中,能正确表示总反应过程中能量变化的是( )
A B C D
C
解析试题分析:①表示反应放热; ②表示反应吸热,所以C图符合题意。
考点:考查了反应能量变化判断。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案对于:2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l);△H =-5800kJ/mol的叙述错误的是
| A.该反应的反应热为△H=-5800kJ/mol,是放热反应 |
| B.该反应的△H与各物质的状态有关,与化学计量数也有关 |
| C.该式的含义为:25℃、101kPa下,2mol C4H10气体完全燃烧生成CO2和液态水时放出热量5800kJ |
| D.该反应为丁烷燃烧的热化学方程式,由此可知丁烷的燃烧热为5800kJ/mol |
在下列各说法中,正确的是
| A.ΔH >0表示放热反应,ΔH <0表示吸热反应 |
| B.1mol H2SO4与1mol Ba(0H)2反应生成BaSO4沉淀时放出的热叫做中和热 |
| C.1mol H2与0.5mol O2反应放出的热就是H2的燃烧热 |
| D.热化学方程式中的化学计量数只表示物质的量,可以是分数 |
在298 K、100 kPa时,已知:
2H2O(g)=O2(g)+2H2(g);ΔH1
Cl2(g)+H2(g)=2HCl(g);ΔH2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g);ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是
| A.ΔH3=ΔH1+2ΔH2 | B.ΔH3=ΔH1+ΔH2 |
| C.ΔH3=ΔH1-2ΔH2 | D.ΔH3=ΔH1-ΔH2 |
已知反应:
①101 kPa时,2C(s)+O2(g) =2CO(g) ΔH=-221 kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq) =H2O(l) ΔH=-57.3 kJ·mol-1
③在同温同压下,S(g)+O2(g)=SO2(g) ΔH1
下列结论正确的是( )
| A.H2SO4和Ba(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol |
| B.C的标准燃烧热为-110.5 kJ·mol-1 |
| C.稀醋酸与稀NaOH溶液反应生成1 mol水放出的热量为57.3 kJ |
| D.由③知S(s)+O2(g)=SO2(g)ΔH2则ΔH2>ΔH1 |
已知下列反应的热化学方程式
6C(s)+5H2(g)+3N2(g)+9O2(g) 2C3H5(ONO2)3(l) ΔH1
2 H2(g)+ O2(g) 2H2O(g) ΔH2
C(s)+ O2(g) CO2(g) ΔH3
则反应4C3H5(ONO2)3(l) 12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为
| A.12ΔH3+5ΔH2-2ΔH1 | B.2ΔH1-5ΔH2-12ΔH3 |
| C.12ΔH3-5ΔH2-2ΔH1 | D.ΔH1-5ΔH2-12ΔH3 |
为了测定酸碱中和反应的中和热,计算时至少需要的数据是
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应后溶液的质量
⑤生成水的物质的量 ⑥反应前后溶液温度变化 ⑦操作所需的时间
| A.①②③⑥ | B.①③④⑥ | C.③④⑤⑥ | D.全部 |
某一化学反应在不同条件下的能量变化曲线如图所示。下列说法正确的是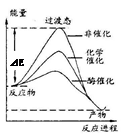
| A.化学催化比酶催化的效果好 |
| B.使用不同催化剂可以改变反应的热效应 |
| C.使用不同催化剂可以改变反应的能耗 |
| D.反应物的总能量低于生成物的总能量 |
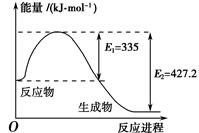
 2NH3(g) ΔH=a kJ·mol-1。
2NH3(g) ΔH=a kJ·mol-1。