��Ŀ����
��֪��Ӧ��
��101 kPaʱ��2C(s)+O2(g) =2CO(g) ��H=��221 kJ��mol-1
��ϡ��Һ�У�H+��aq��+OH��(aq) =H2O(l) ��H=��57.3 kJ��mol-1
����ͬ��ͬѹ�£�S��g��+O2��g��=SO2��g�� ��H1
���н�����ȷ���ǣ� ��
| A��H2SO4��Ba(OH)2��Ӧ���к��Ȧ�H��2��(��57.3)kJ/mol |
| B��C�ı�ȼ����Ϊ��110.5 kJ��mol-1 |
| C��ϡ������ϡNaOH��Һ��Ӧ����1 molˮ�ų�������Ϊ57.3 kJ |
| D���ɢ�֪S��s��+O2��g��=SO2��g����H2��H2����H1 |
D
�������������Aѡ������к���Ϊ��ϡ��Һ�У��������кͷ�Ӧ����1 molˮʱ�ķ�Ӧ�� ����һ����ϡ��Һ����Ϊǿ��ǿ�����Bѡ�̼�ı�ȼ����Ӧ�ڲ���ΪCO2��������ų�������������Cѡ����ϡ����������ڴ���Ϊ������ʣ�����ʱ��Ҫ��������������D��ȷ��ͬ������������������̬��Һ̬����̬��
���㣺��Ӧ�ȣ��к��ȣ�ȼ���ȶ��忼�顣

 ������ȫ�̼����ĩ���100��ϵ�д�
������ȫ�̼����ĩ���100��ϵ�д����б仯���̣����ڷ��ȷ�Ӧ���ǣ� ��
��Һ̬ˮ���ˮ���� ������кͷ�Ӧ ��ŨH2SO4ϡ��
�ܹ���NaOH����ˮ ��H2��Cl2��ȼ�� ���������
| A���ڢۢܢ� | B���ڢۢ� | C���ڢ� | D���٢ۢ� |
��˹������Ϊ�����ܻ�ѧ������һ����ɻ��Ϊ������ɣ�������̵���ЧӦ����ͬ�ġ�
��֪��H2O��g��=H2O��l����H1 =��Q1kJ/mol
C2H5OH��g��=C2H5OH��l�� ��H2 =��Q2kJ/mol
C2H5OH��g��+3O2��g��=2CO2��g��+3H2O��g�� ��H3 =��Q3kJ/mol
��ʹ0��5mol�Ҵ�Һ����ȫȼ�գ����ָ������£���ų�������Ϊ��kJ��
| A��Q1+Q2+Q3 |
| B��0��5��Q1+Q2+Q3�� |
| C��0��5 Q2��1��5 Q1��0��5Q3 |
| D��1��5 Q1��0��5 Q2+0��5Q3 |
���й�������ת������ʶ�в���ȷ����
| A��ԭ��ع���ʱ��ѧ��ȫ��ת��Ϊ���� |
| B����ҵ�ϵ���������Ʊ���������ת���ɻ�ѧ�� |
| C��þ�ڿ�����ȼ��ʱ��ѧ�ܲ�ֻת������� |
| D����ɫֲ�������ù�����̫����ת��ɻ�ѧ�� |
���й��ڻ�ѧ��Ӧ��������˵����ȷ���ǣ� ��
| A����ѧ��Ӧ��һ�������ʱ仯����һ���������仯 |
B��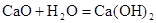 �Ƿ��ȷ�Ӧ��˵��CaO���������� �Ƿ��ȷ�Ӧ��˵��CaO����������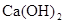 ������ ������ |
C��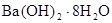 �������Ȼ�茶��巴Ӧ����Ҫ���Ⱦ��ܷ�����˵���÷�Ӧ�Ƿ��ȷ�Ӧ �������Ȼ�茶��巴Ӧ����Ҫ���Ⱦ��ܷ�����˵���÷�Ӧ�Ƿ��ȷ�Ӧ |
| D����H2��2H�Ĺ�����Ҫ�������� |
��ͼΪ��Ӧ2X(g)+Y(s)  2Z(g)�ķ�Ӧ���̺�������ϵͼ������˵����ȷ���ǣ� ��
2Z(g)�ķ�Ӧ���̺�������ϵͼ������˵����ȷ���ǣ� ��
| A������a��b��ʾ������Ӧ���̵ķ�Ӧ�Ȳ�ͬ |
| B������aһ����ʾ��Ӧ��������ʱ�ķ�Ӧ���� |
| C������ѹǿ��X��ת����һ������ |
| D����Ӧ�ﵽƽ��������¶ȣ�ƽ�ⳣ��Kֵһ����С |
����˵�����ʾ������ȷ����
| A�������ʵ������������������ֱ���ȫȼ�գ����߷ų������� |
| B����C��ʯī��=C�����ʯ����H="+1.90" kJ��mol-1��֪�����ʯ��ʯī�ȶ� |
| C����ϡ��Һ�У�H+��aq����+OH-��aq����=H2O��l����H=��57.3 kJ��mol-1��������0.5 molH2SO4��Ũ�����뺬1 mol NaOH����Һ��ϣ��ų����ȴ���57.3 kJ |
| D����101 kPaʱ��2 g H2��ȫȼ������Һ̬ˮ���ų�285.8 kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ��2 H2��g��+O2��g��="2" H2O��1����H=��285.8 kJ��mol-1 |

