题目内容
某一化学反应在不同条件下的能量变化曲线如图所示。下列说法正确的是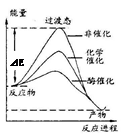
| A.化学催化比酶催化的效果好 |
| B.使用不同催化剂可以改变反应的热效应 |
| C.使用不同催化剂可以改变反应的能耗 |
| D.反应物的总能量低于生成物的总能量 |
C
解析试题分析:A、酶的反应条件容易,催化效率更高,错误;B、催化剂改变活化能,不改变热效应,错误;C、改变反应的活化能,故改变能耗,正确;D、该反应放热,故反应物的总能量高于生成物的总能量。
考点:化学反应与热能的关系。

已知298 K、101 kPa条件下:
①4Al(s)+3O2(g)=2Al2O3(s) ΔH=-2834.9 kJ·mol-1
②4Al(s)+2O3(g)=2Al2O3(s) ΔH=-3119.1 kJ·mol-1
由此得出的正确结论是( )
| A.等质量的O2比O3能量低,由O2变为O3为放热反应 |
| B.O3比O2稳定,由O2变为O3为吸热反应 |
| C.O2比O3稳定,由O2变为O3为放热反应 |
| D.等质量的O2比O3能量低,由O2变为O3为吸热反应 |
下列关于燃烧热和中和热的比较中,错误的是
| A.两者对应反应的△H均小于0 |
| B.两者的单位均为kJ·mol-1,但mol-1的含义不同 |
| C.两者的数值均不随反应物用量改变而改变 |
| D.两者的数值均随反应物改变而改变 |
已知: (1)NH3(g)+HCl(g)=NH4Cl(s); △H1=-76kJ·mol-1
(2)NH3(g)+H2O(l)=NH3·H2O(aq); △H2=-35.1kJ·mol-1
(3)HCl(g)+HCl (aq); △H3=-72.3kJ·mol-1
(4)HCl (aq) NH3·H2O(aq) =NH4Cl(aq)+H2O(l); △H4=-52.3kJ·mol-1
(5)NH4Cl(s)=NH2Cl(aq); △H5=?
根据盖斯定律,则(5)方程式中的反应热△H5为
| A.-335.7 kJ·mol-1 | B.-16.3 kJ·mol-1 |
| C.+16.3 kJ·mol-1 | D.-83.7 kJ·mol-1 |
由金红石(TiO2)制取单质Ti涉及到的步骤为:
TiO2 TiCl4
TiCl4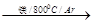 Ti
Ti
已知:①C(s)+O2(g)=CO2(g) DH=-393.5kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) DH=-566kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) DH=+141kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH是
| A.-80kJ·mol-1 | B.-160kJ·mol-1 | C.160kJ·mol-1 | D.80kJ·mol-1 |
用H2O2和H2SO4的混合溶液可溶出废旧印刷电路板上的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH=+64.39kJ/mol
2H2O2(l)=2H2O(l)+O2(g) ΔH=-196.46kJ/mol
H2(g)+ O2(g)=H2O(l) ΔH=-285.84kJ/mol
O2(g)=H2O(l) ΔH=-285.84kJ/mol
在H2SO4溶液中,Cu与H2O2反应生成Cu2+(aq)和H2O(l)的反应热ΔH等于
| A.-417.91kJ·mol-1 | B.-319.68 kJ·mol-1 |
| C.+546.69 kJ·mol-1 | D.-448.46 kJ·mol-1 |

