题目内容
在下列各说法中,正确的是
| A.ΔH >0表示放热反应,ΔH <0表示吸热反应 |
| B.1mol H2SO4与1mol Ba(0H)2反应生成BaSO4沉淀时放出的热叫做中和热 |
| C.1mol H2与0.5mol O2反应放出的热就是H2的燃烧热 |
| D.热化学方程式中的化学计量数只表示物质的量,可以是分数 |
D
解析试题分析:A.ΔH >0表示吸热反应,ΔH <0表示放热反应。错误。B.酸和碱发生中和反应生成1mol的水时放出的热叫做中和热。1mol H2SO4与1mol Ba(0H)2反应生成BaSO4沉淀时产生2mol的水。所以错。C.1mol 物质完全燃烧产生稳定的化合物时放出的热叫燃烧热。1mol H2与0.5mol O2反应得到的水可能是气态也可能是液态,放出的能量并不相同。所以错误。 D.热化学方程式中的化学计量数表示物质的量的关系,可以是分数。正确。
考点:考查燃烧热、中和热的概念及热化学方程式的意义等知识。

 阅读快车系列答案
阅读快车系列答案已知充分燃烧a g乙炔(C2H2)气体时生成1 mol CO2气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是
| A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)ΔH=-4b kJ·mol-1 |
B.C2H2(g)+ O2(g)=2CO2(g)+H2O(l)ΔH=2b kJ·mol-1 O2(g)=2CO2(g)+H2O(l)ΔH=2b kJ·mol-1 |
| C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)ΔH=-2b kJ·mol-1 |
| D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)ΔH=-b kJ·mol-1 |
1克氢气燃烧生成液态水放出142.9 kJ热量,表示该反应的热化学方程式正确的是( )
| A.2H2(g)+O2(g)=2H2O(l);△H="-285.8" kJ/mol |
| B.H2(g)+1/2O2(g)=H2O(g);△H=-142.9kJ/mol |
| C.H2O(l)=H2(g)+1/2O2(g); △H="+285.8" kJ/mol |
| D.2H2+O2=2H2O;△H="-571.6" kJ/mol |
已知氢气和碳燃烧的热化学方程式为:
①2H2(g)+O2(g)=2H2O(l) △H1=-akJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) △H2=-bkJ·mol-1
③C(s)+1/2O2(g)=CO(g) △H3=-ckJ·mol-1
④C(s)+O2(g)=CO2(g) △H4=-dkJ·mol-1
下列说法错误的是
| A.氢气的燃烧热为△H=-akJ·mol-1 | B.c<d |
| C.一氧化碳的燃烧热为△H=-(d-c)kJ·mol-1 | D.0.5a>b |
盖斯定律认为:不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的。
已知:H2O(g)=H2O(l)ΔH1 =-Q1kJ/mol
C2H5OH(g)=C2H5OH(l) ΔH2 =-Q2kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3 =-Q3kJ/mol
若使0.5mol乙醇液体完全燃烧,最后恢复到室温,则放出的热量为(kJ)
| A.Q1+Q2+Q3 |
| B.0.5(Q1+Q2+Q3) |
| C.0.5 Q2-1.5 Q1-0.5Q3 |
| D.1.5 Q1-0.5 Q2+0.5Q3 |
已知(1)H2(g)+ O2(g)=H2O(g); DH1=akJ·mol-1
O2(g)=H2O(g); DH1=akJ·mol-1
(2)2H2(g)+O2(g)=2H2O(g) ; DH2=b kJ·mol-1
(3)H2(g)+ O2(g)=H2O(l) ; DH3=c kJ·mol-1
O2(g)=H2O(l) ; DH3=c kJ·mol-1
(4)2H2(g)+O2(g)=2H2O(l) ; DH4=d kJ·mol-1
下列关系式中正确的是
| A.a<c<0 | B.b>d>0 | C.2a=b<0 | D.2c=d>0 |
已知298 K、101 kPa条件下:
①4Al(s)+3O2(g)=2Al2O3(s) ΔH=-2834.9 kJ·mol-1
②4Al(s)+2O3(g)=2Al2O3(s) ΔH=-3119.1 kJ·mol-1
由此得出的正确结论是( )
| A.等质量的O2比O3能量低,由O2变为O3为放热反应 |
| B.O3比O2稳定,由O2变为O3为吸热反应 |
| C.O2比O3稳定,由O2变为O3为放热反应 |
| D.等质量的O2比O3能量低,由O2变为O3为吸热反应 |
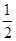 O2(g)=CO(g) ΔH2
O2(g)=CO(g) ΔH2