题目内容
2.25℃时,将a mol(NH4)2SO4 溶于水,向该溶液中滴加V L稀氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将逆向 (填正向、不、逆向)移动,所滴加的稀氨水的物质的量浓度为$\frac{a}{100V}$mol/L.(25℃时,NH3•H2O的电离平衡常数K=2×10-5)分析 滴加氨水的过程中,氨水电离产生的OH-对水的电离平衡起抑制作用;根据电荷守恒,求溶液中铵根离子的物质的量.
解答 解:向(NH4)2SO4溶液中滴加稀氨水的过程中水的电离平衡受到抑制,H2O?H++OH-,加入酸和碱平衡逆向移动,因此加氨水对水的电离起逆向移动;由amol(NH4)2SO4溶于水,向该溶液中滴加VL稀氨水后溶液呈中性可知,c(OH-)=10-7mol/L,
设平衡时NH3•H2O的物质的量为x,溶液的体积为b,
则:NH3•H2O?NH4++OH-
x/b 2a/b 10-7
由电离平衡常数可知:$\frac{\frac{2a}{b}×1{0}^{-7}}{\frac{x}{b}}$=2×10-5,解之得:x=$\frac{a}{100}$,则c(NH3•H2O)=$\frac{a}{100V}$mol/L,
故答案为:逆向;$\frac{a}{100V}$.
点评 本题考查影响水的电离平衡移动的因素、电离平衡常数的计算,但难度不大.

练习册系列答案
相关题目
12.如表列出了①~⑨九种元素在周期表中的位置:
请按要求回答下列问题.
(1)元素④在周期表中所处位置第二周期ⅥA族⑤、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是P3->S2->Na+.
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性:PH3<H2S<H2O(写氢化物的化学式).
(3)元素⑦的原子结构示意图是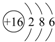 .
.
(4)用电子式表示①与⑨反应得到的化合物的形成过程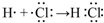 .
.
| ⅠA | ⅧA | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑧ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
(1)元素④在周期表中所处位置第二周期ⅥA族⑤、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是P3->S2->Na+.
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性:PH3<H2S<H2O(写氢化物的化学式).
(3)元素⑦的原子结构示意图是
 .
.(4)用电子式表示①与⑨反应得到的化合物的形成过程
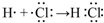 .
.
13.有四种短周期元素,它们的结构、性质等信息如下表所述:
请根据表中信息填写:
(1)X元素在周期表中的位置是第二周期第IVA族,其相对分子质量最小的气态氢化物的化学式是CH4.
(2)Y离子半径比Z离子的半径大(填“大”或“小”),Y元素的最高价氧化物的水化物和Z元素的最高价氧化物相互反应的离子方程式是:Al2O3+2OH-=2AlO2-+H2O.
(3)X与M两元素的气态氢化物的稳定性更强的是HCl(填化学式),请再举出一个实例比较M与X两元素的非金属性强弱(用化学方程式表示)Na2CO3+2HClO4=2NaClO4+CO2↑+H2O.
| 元素 | 结构、性质等信息 |
| X | 构成有机物的核心元素,该元素的一种氧化物和气态氢化物都是典型的温室气体 |
| Y | 短周期中(除稀有气体外)原子半径最大的元素,该单质液态时可用作核反应堆的传热介质 |
| Z | 与Y同周期,其最高价氧化物的水化物呈两性 |
| M | 海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
(1)X元素在周期表中的位置是第二周期第IVA族,其相对分子质量最小的气态氢化物的化学式是CH4.
(2)Y离子半径比Z离子的半径大(填“大”或“小”),Y元素的最高价氧化物的水化物和Z元素的最高价氧化物相互反应的离子方程式是:Al2O3+2OH-=2AlO2-+H2O.
(3)X与M两元素的气态氢化物的稳定性更强的是HCl(填化学式),请再举出一个实例比较M与X两元素的非金属性强弱(用化学方程式表示)Na2CO3+2HClO4=2NaClO4+CO2↑+H2O.
17.下列有机物的命名肯定错误的是( )
| A. | 3-甲基-2-戊烯 | B. | 3-甲基-2-丁烯 | C. | 2,2-二甲基丙烷 | D. | 2-甲基-1-丁炔 |
7.以NA代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)?2CO2(g)+H2O(l)△H=-1 300kJ•mol-1的说法中,正确的是( )
| A. | 当10NA个电子转移时,该反应放出1 300 kJ的能量 | |
| B. | 当1NA个水分子生成且为液体时,吸收1300 kJ的能量 | |
| C. | 当2NA个碳氧共用电子对生成时,放出1300 kJ的能量 | |
| D. | 当4NA个碳氧共用电子对生成时,放出1300 kJ的能量 |





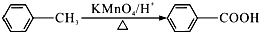
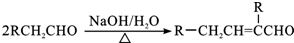
 .
. .
. 或
或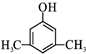 (写出其中一种的结构简式).
(写出其中一种的结构简式).