题目内容
5.将“废杂铜烟尘”用硫酸吸收浸取,既可保护环境又可得到用途广泛的高纯硫酸锌.已知烟尘中主要含ZnO,还有少量的FeO、Fe2O3、CuO、MnO.制备工艺流程如图:(1)硫酸锌溶液滴入石蕊试液,溶液变红,其原因是Zn2+水解使溶液显酸性,Zn2++2H2O?Zn(OH)2+2H+.
(2)H2O2氧化Fe2+的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)“除铁”时,溶液的pH应调整到3.2~5.2(相关金属离子生成氢氧化物沉淀的pH及沉淀完全的pH,金属离子开始沉淀时的浓度为1mol•L-1).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.5 | 8.0 |
| Cu2+ | 5.2 | 6.7 |
| Fe2+ | 5.8 | 8.8 |
(5)试剂X为Zn粉.
(6)由ZnSO4溶液需经过:蒸发浓缩、冷却结晶、过滤及干燥得ZnSO4•7H2O.
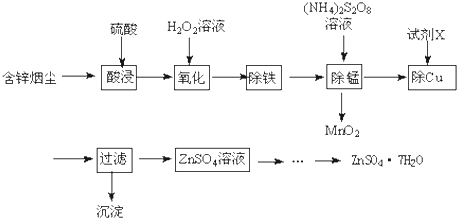
分析 烟尘中主要含ZnO,还有少量的FeO、Fe2O3、CuO、MnO,加入硫酸溶解得到溶液中含有FeSO4、Fe2(SO4)3、CuSO4、MnSO4,ZnSO4,加入过氧化氢氧化亚铁离子为铁离子,调节溶液PH使铁离子全部沉淀,过滤得到滤液中加入(NH4)2S2O8,除去锰过滤得到MnO2,在溶液中加入过量锌粉生成金属铜过滤得到金属铜和锌,滤液中为硫酸锌,通过蒸发浓缩,冷却结晶,过滤洗涤,干燥得到ZnSO4•7H2O;
(1)硫酸锌溶液滴入石蕊试液,溶液变红,是因为锌离子水解的原因;
(2)H2O2在酸性溶液中氧化Fe2+为铁离子;
(3)分析图表数据使铁离子沉淀且不沉淀Cu2+、Zn2+,调节溶液PH在3.2~5.2;
(4)“除锰”时溶液中发生的反应加入(NH4)2S2O8氧化MnSO4,生成二氧化锰;
(5)过程分析可知,加入试剂X是置换铜除去;
(6)硫酸锌溶液通过蒸发浓缩,冷却结晶,过滤洗涤,干燥得到ZnSO4•7H2O.
解答 解:烟尘中主要含ZnO,还有少量的FeO、Fe2O3、CuO、MnO,加入硫酸溶解得到溶液中含有FeSO4、Fe2(SO4)3、CuSO4、MnSO4,ZnSO4,加入过氧化氢氧化亚铁离子为铁离子,调节溶液PH使铁离子全部沉淀,过滤得到滤液中加入(NH4)2S2O8,除去锰过滤得到MnO2,在溶液中加入过量锌粉生成金属铜过滤得到金属铜和锌,滤液中为硫酸锌,通过蒸发浓缩,冷却结晶,过滤洗涤,干燥得到ZnSO4•7H2O;
(1)硫酸锌溶液滴入石蕊试液,溶液变红,是因为锌离子水解的原因,Zn2+水解使溶液显酸性,Zn2++2H2O?Zn(OH)2+2H+,
故答案为:Zn2+水解使溶液显酸性,Zn2++2H2O?Zn(OH)2+2H+;
(2)H2O2在酸性溶液中氧化Fe2+为铁离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)分析图表数据使铁离子沉淀且不沉淀Cu2+、Zn2+,调节溶液PH在3.2~5.2沉淀铁离子,铜离子和锌离子,
故答案为:3.2~5.2;
(4)“除锰”时溶液中发生的反应加入(NH4)2S2O8氧化MnSO4,生成二氧化锰,反应的离子方程式为;MnSO4+(NH4)2S2O8+2H2O=MnO2↓+(NH4)2SO4+2H2SO4或:MnSO4+(NH4)2S2O8+2H2O=MnO2↓+2NH4HSO4+H2SO4,
故答案为;MnSO4+(NH4)2S2O8+2H2O=MnO2↓+(NH4)2SO4+2H2SO4或:MnSO4+(NH4)2S2O8+2H2O=MnO2↓+2NH4HSO4+H2SO4;
(5)除锰后的溶液中,加入试剂X是置换铜除去且不引入锌的杂质,所以应加入过量的锌完全置换铜,过滤得到硫酸锌溶液,故答案为:Zn粉;
(6)溶液中得到溶质固体的方法为,硫酸锌溶液通过蒸发浓缩,冷却结晶,过滤洗涤,干燥得到ZnSO4•7H2O.故答案为:蒸发浓缩;冷却结晶.
点评 本题考查了物质分离的方法和提纯过程分析判断,试剂选择和除杂的溶液PH分析判断,主要是离子性质分析,离子方程式书写,掌握基础是关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 青铜器、硬币都属于纯净物 | |
| B. | 葡萄糖和银氨溶液发生银镜反应可用作制镜子 | |
| C. | 铺路用的沥青主要含有C、H、O等元素 | |
| D. | 鸡蛋清中加入胆矾可以使蛋白质发生盐析 |
| A. | 碳酸银溶于稀硝酸:Ag2CO3+2H+═2Ag++CO2↑+H2O | |
| B. | AlCl3溶液中加入过量的氢氧化钠溶液:Al3++3OH-═Al(OH)3↓ | |
| C. | 硅酸钠溶液与盐酸混合:Na2SiO3+2H+═H2SiO3(胶体)+2Na+ | |
| D. | 澄清石灰水中加入足量的碳酸氢钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
| A. | D>C>B>A | B. | A>B>C>D | C. | B>A>C>D | D. | A>B>D>C |
| 选项 | 含杂质的物质 | 试剂 | 除杂方法 |
| A | C2H4(SO2) | NaOH溶液 | 洗气 |
| B | C6H6(Br2) | Fe粉 | 蒸馏 |
| C | C6H5NO2(HNO3) | NaOH溶液 | 分液 |
| D | C2H6(C2H4) | 酸性KMnO4溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |

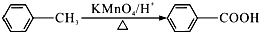
 .
. .
. 或
或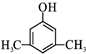 (写出其中一种的结构简式).
(写出其中一种的结构简式).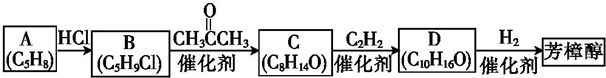
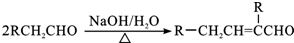
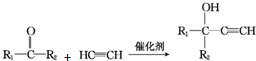 (R1、R2均为烃基)
(R1、R2均为烃基) ,该反应类型为加成反应.
,该反应类型为加成反应.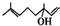 .
.