题目内容
9.(1)10mLpH=4的盐酸,稀释10倍到100mL时,pH=5.(2)常温下,pH=5和pH=3的盐酸溶液等体积混合后溶液的pH=3.3.
分析 (1)根据氢离子的物质的量相等计算稀释后溶液中氢离子浓度,再计算溶液的PH;
(2)酸溶液混合,先计算混合后溶液中氢离子的物质的量,再根据c=$\frac{n}{V}$计算氢离子的物质的量浓度,最后根据pH=-lgc(H+)计算出混合液的pH.
解答 解:(1)10mLpH=4的硫酸,稀释10倍到100mL时,溶液体积增大10倍,则氢离子浓度减小为原来的$\frac{1}{10}$,所以其pH增大1,稀释后溶液的pH=5,故答案为:5;
(2)pH=3的盐酸和pH=5的硫酸等体积混合后,设体积均为VL,
混合液中氢离子的物质的量为:n(H+)=VL×10-3mol/L+VL×10-5mol/L≈10-3Vmol,
则混合溶液中氢离子浓度为:c(H+)=$\frac{1{0}^{-3}mol}{2VL}$=5×10-4mol/L,
所以pH=-lg5×10-4=4-lg5=3.3,
故答案为:3.3.
点评 本题考查了混合液的pH的计算,题目难度不大,试题侧重基础知识的考查,注意掌握pH的表达式及计算方法,明确溶液酸碱性与溶液pH的关系为解答关键,试题有利于培养学生的化学计算能力.

练习册系列答案
相关题目
19.电负性的大小也可以作为判断元素金属性和非金属性强弱的尺度.下列关于电负性的变化规律正确的是( )
| A. | 周期表从左到右,元素的电负性逐渐变大 | |
| B. | 周期表从上到下,元素的电负性逐渐变大 | |
| C. | 电负性越大,金属性越强 | |
| D. | 电负性越小,非金属性越强 |
17.下列有机物的命名肯定错误的是( )
| A. | 3-甲基-2-戊烯 | B. | 3-甲基-2-丁烯 | C. | 2,2-二甲基丙烷 | D. | 2-甲基-1-丁炔 |
4.某元素的结构示意图如图所示,该元素在周期表中位于第几周期,( )
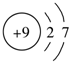

| A. | 一 | B. | 二 | C. | 三 | D. | 四 |
18.下列一组粒子的中心原子杂化类型相同,分子或离子的键角不相等的是( )
| A. | CCl4、SiCl4、SiH4 | B. | H2S、NF3、CH4 | ||
| C. | BCl3、CH2═CHCl、环己烷 | D. | SO3、C6H6(苯)、CH3C≡CH |
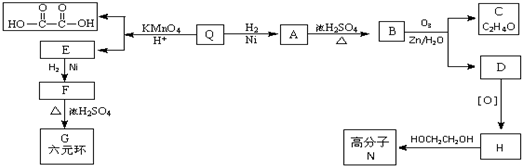
 ;Q的反式结构简式是
;Q的反式结构简式是 .
. .
. K2S
K2S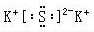 NaOH
NaOH
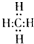 ,分子里各原子的空间分布呈正四面体结构.分子式为C4Hm的烷烃,m值等于10;并写出它的同分异构体的结构简式CH3CH2CH2CH3、(CH3)2CHCH3.
,分子里各原子的空间分布呈正四面体结构.分子式为C4Hm的烷烃,m值等于10;并写出它的同分异构体的结构简式CH3CH2CH2CH3、(CH3)2CHCH3.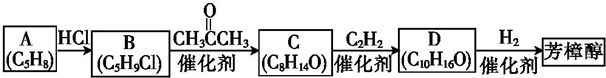
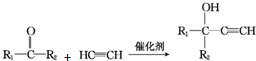 (R1、R2均为烃基)
(R1、R2均为烃基) ,该反应类型为加成反应.
,该反应类型为加成反应.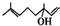 .
.