题目内容
4.下表为元素周期表的一部分,请根据元素①-⑨在表中的位置,用化学用语回答下列问题: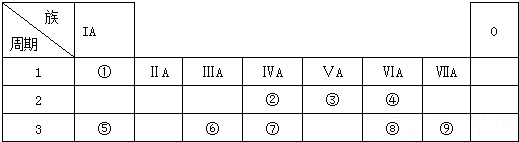
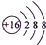
(1)上述元素中金属性最强的元素为Na,⑧的离子结构示意图
(2)④、⑤、⑥的原子半径由大到小的顺序为Na>Al>O
(3)④、⑤形成的一种化合物是淡黄色固体,写出它的电子式
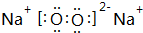 ,含有的化学键类型有离子键、共价键
,含有的化学键类型有离子键、共价键(4)请写出能证明②的非金属性比⑦强的化学方程式Na2SiO3+H2O+CO2=H2SiO3↓+Na2CO3.
(5)下列说法正确的是ad
a.①⑤④比①⑥④组成的化合物碱性强
b.④的氢化物比⑧的氢化物沸点高,是因为其共价键更稳定
c.③的非金属性强于②,故③的含氧酸的酸性一定强于②的含氧酸的酸性
d.④的氢化物固态时的密度小于液态时密度,与氢键有关
(6)化合物A由元素④和⑨组成,相同条件下,气态A相对空气的密度为3,化合物A中元素④的质量分数为约为18.4%,A可与NH3反应,生成一种离子化合物B、气体单质C和一种常见液体D,C为空气的主要成分.化合物A的化学式为Cl2O,写出A与NH3反应的化学方程式3Cl2O+10NH3=6NH4Cl+2N2+3H2O.
分析 由元素在周期表中的位置,可知①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是S,⑨是Cl.
(1)同周期自左而右金属性减弱、同主族自上而下金属性增强;硫离子核外有3个电子层,各层电子数为2、8、8;
(2)同周期自左而右原子半径减小、同主族自上而下原子半径增大;
(3)④、⑤形成的一种化合物是淡黄色固体为Na2O2,由钠离子与过氧根离子构成;
(4)利用最高价含氧酸的酸性强弱比较,即利用强酸制备弱酸;
(5)a.金属性越强,最高价氧化物对应水化物的碱性越强;
b.水分子之间存在氢键,沸点高于硫化氢;
c.应是最高价含氧酸的酸性③强于②;
d.冰分子之间形成氢键,每个水分子与周围的4个水分子形成四面体结构,冰晶体中水分子之间有相当大的空间,空间利用率低;
(6)化合物A由元素④和⑨组成,相同条件下,气态A相对空气的密度为3,则Mr(A)=29×3=87,A中元素④的质量分数为约为18.4%,则O原子数目为$\frac{87×18.4%}{16}$=1,Cl原子数目为$\frac{87-16}{35.5}$=2,故A的化学式为Cl2O,A与NH3反应,生成一种离子化合物B、气体单质C和一种常见液体D,C为空气的主要成分,则B为NH4Cl、C为N2、D为H2O.
解答 解:由元素在周期表中的位置,可知①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是S,⑨是Cl.
(1)同周期自左而右金属性减弱、同主族自上而下金属性增强,故上述元素中Na的金属性最强;硫离子核外有3个电子层,各层电子数为2、8、8,离子结构示意图为 ,
,
故答案为:Na; ;
;
(2)同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:Na>Al>O,
故答案为:Na>Al>O;
(3)④、⑤形成的一种化合物是淡黄色固体为Na2O2,由钠离子与过氧根离子构成,电子式为 ,含有离子键、共价键,
,含有离子键、共价键,
故答案为: ;离子键、共价键;
;离子键、共价键;
(4)利用最高价含氧酸的酸性强弱比较,即利用强酸制备弱酸,反应方程式为:Na2SiO3+H2O+CO2=H2SiO3↓+Na2CO3,
故答案为:Na2SiO3+H2O+CO2=H2SiO3↓+Na2CO3;
(5)a.金属性Na>Al,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性氢氧化钠>氢氧化铝,故a正确;
b.共价键影响其稳定性,水分子之间存在氢键,沸点高于硫化氢,故b错误;
c.应是最高价含氧酸的酸性③强于②,故c错误;
d.冰分子之间形成氢键,每个水分子与周围的4个水分子形成四面体结构,冰晶体中水分子之间有相当大的空间,空间利用率低,固态时的密度小于液态时密度,故d正确,
故选:ad;
(6)化合物A由元素④和⑨组成,相同条件下,气态A相对空气的密度为3,则Mr(A)=29×3=87,A中元素④的质量分数为约为18.4%,则O原子数目为$\frac{87×18.4%}{16}$=1,Cl原子数目为$\frac{87-16}{35.5}$=2,故A的化学式为Cl2O,A与NH3反应,生成一种离子化合物B、气体单质C和一种常见液体D,C为空气的主要成分,则B为NH4Cl
、C为N2、D为H2O,反应方程式为:3Cl2O+10NH3=6NH4Cl+2N2+3H2O,
故答案为:Cl2O;3Cl2O+10NH3=6NH4Cl+2N2+3H2O.
点评 本题考查元素周期表与元素周期律的综合应用,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.

| A. | 原子晶体中的各相邻原子都以共价键相结合 | |
| B. | 金属导电的原因是在外电场作用下金属产生自由电子,电子定向运动 | |
| C. | 分子晶体的熔沸点很低,常温下都呈液态或气态 | |
| D. | 离子晶体中每个离子周围均吸引着6个带相反电荷的离子 |
| A. | 用反应物A表示该反应的反应速率为0.6 mol•L-1•min-1 | |
| B. | 用反应物B表示该反应的反应速率为1.8 mol•L-1•min-1 | |
| C. | 反应达到平衡时$\frac{2}{3}$v(B)正=v(C)逆 | |
| D. | 升高温度可加快正反应的速率,同时降低逆反应的速率 |
 溴苯是一种化工原料,实验室用以下甲、乙、丙、丁等仪器组合,合成溴苯的装置示意图(其余辅助仪器略去)及有关数据如下,按要求回答下列问题:
溴苯是一种化工原料,实验室用以下甲、乙、丙、丁等仪器组合,合成溴苯的装置示意图(其余辅助仪器略去)及有关数据如下,按要求回答下列问题:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/°C | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(2)用如图的装置制备溴苯时的操作为:向甲中预先加入少量铁屑,再加入适量苯,丙中预先装好适量液溴,将丙中所装的液溴缓慢滴入甲中,充分反应.反应中铁屑的作用是:催化剂;
写出制备溴苯的化学反应方程式是:C6H6+Br2$\stackrel{Fe}{→}$C6H5Br+HBr;
(3)丁装置烧杯中倒置的漏斗的目的是:防倒吸;
写出丁中发生的主要化学反应的方程式为:NaOH+HBr=NaBr+H2O;
(4)充分反应后,向甲中加入适量水,然后过滤除去未反应的铁屑;所得到滤液就是制得的粗溴苯,其中含有未反应完的液溴,最好应选择试剂A除去,
A 氢氧化钠溶液 B稀盐酸溶液 C氯化钠溶液 D水
经过上述操作所得的粗溴苯中还含有杂质苯,要进一步提纯,应选下列哪种操作G除去.
E 重结晶 F 过滤 G 蒸馏 H 萃取.
| A. | K+、NH4+、OH-、SO42- | B. | H+、Fe2+、SO42-、ClO- | ||
| C. | Na+、Ca2+、Cl-、CO32- | D. | K+、Ca2+、Cl-、NO3- |
| A. | v(NH3)=0.3 mol/(L•min) | B. | v(N2)=0.01 mol/(L•s) | ||
| C. | v(N2)=0.2 mol/(L•min) | D. | v(H2)=0.3 mol/(L•min) |
| A. | 放热反应 | B. | 吸热反应 | C. | 氧化还原反应 | D. | 可逆反应 |
| A. | H2O | B. | CaO | C. | NaCl | D. | NaOH |