题目内容
15.一定条件下反应A(s)+3B(g)?2C(g)在10L的密闭容器中进行,测得2min内,A的物质的量由20mol减小到8mol,则下列说法中正确的是( )| A. | 用反应物A表示该反应的反应速率为0.6 mol•L-1•min-1 | |
| B. | 用反应物B表示该反应的反应速率为1.8 mol•L-1•min-1 | |
| C. | 反应达到平衡时$\frac{2}{3}$v(B)正=v(C)逆 | |
| D. | 升高温度可加快正反应的速率,同时降低逆反应的速率 |
分析 A.A是固体,固体没有浓度而言,所以不能用其浓度变化量计算反应速率;
B.测得2min内,A的物质的量由20mol减小到8mol,则A参加反应的物质的量=20mol-8mol=12mol,根据方程式知,参加反应的B的物质的量为12mol×3=36mol,B的反应速率=$\frac{\frac{△n}{V}}{△t}$;
C.同一反应中,正逆反应速率相等即达到平衡状态;
D.升高温度,正逆反应速率都增大.
解答 解:A.A是固体,固体没有浓度而言,所以不能用其浓度变化量计算反应速率,故A错误;
B.测得2min内,A的物质的量由20mol(560g)减小到8mol(224g),则A参加反应的物质的量=20mol-8mol=12mol,根据方程式知,参加反应的B的物质的量为12mol×3=36mol,B的反应速率=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{36mol}{10L}}{2min}$=1.8mol•L-1•min-1,故B正确;
C.同一反应中,各物质的反应速率之比等于其计量数之比,所以2v(B)正=3v(C)正,所以$\frac{2}{3}$v(B)正=v(C)正=v(C)逆,即反应达到平衡,故C正确;
D.升高温度,正逆反应速率都增大,故D错误;
故选BC.
点评 本题考查化学反应速率的有关计算,明确反应速率与计量数的关系即可解答,侧重考查分析计算能力,易错选项是A,注意固体和纯液体不能计算反应速率.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
5.有关晶体的下列说法中正确的是( )
| A. | 原子晶体中共价键越强,熔点越高 | |
| B. | 晶体中分子间作用力越大,分子越稳定 | |
| C. | 冰融化时水分子中共价键发生断裂 | |
| D. | 氯化钠熔化时离子键未被破坏 |
6.常温常压下,将盛有20mL NO2和O2的混合气体的大试管倒立在水槽中,水面上升至一定位置后不再变化,此时还有3mL气体,则原混合气体中的NO2的体积可能是( )
| A. | 17.8 mL | B. | 14.8 mL | C. | 12.6 mL | D. | 12.4 mL |
10.下列说法错误的是( )
| A. | 元素周期表共有18个纵行 | |
| B. | 电子层数相同的原子一定属于同一周期 | |
| C. | 原子最外层电子数为2的元素一定在ⅡA族 | |
| D. | 62144Sm与62145Sm互为同位素 |
20. 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述不正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述不正确的是( )
 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述不正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述不正确的是( )| A. | 1mol该物质完全燃烧最多能消耗10.5mol的氧气 | |
| B. | 能使酸性KMnO4溶液褪色 | |
| C. | 1mol该物质最多能与4 molH2加成 | |
| D. | 分子式为C10H9O3 |
7.某阳离子${\;}_{Z}^{42}$X2+核外电子数为18,下列说法叙述正确的是( )
| A. | Z=18 | B. | X原子核内的中子数为20 | ||
| C. | Z=20 | D. | X原子核内的中子数为24 |
5.下列说法正确的是( )
| A. | ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| B. | 电子层数越多的原子半径越大 | |
| C. | 同周期非金属氧化物对应的水化物酸性从左到右依次增强 | |
| D. | ⅥA族元素的氢化物中,稳定性最好的沸点也最高 |
 上世纪60年代,第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对惰性”的观念.在随后的几年内,科学家又相继合成了氙的氟化物、氧化物等.
上世纪60年代,第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对惰性”的观念.在随后的几年内,科学家又相继合成了氙的氟化物、氧化物等.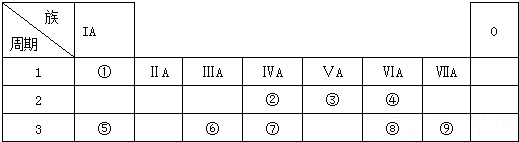
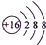
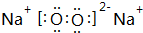 ,含有的化学键类型有离子键、共价键
,含有的化学键类型有离子键、共价键