题目内容
14.下列说法中,正确的是( )| A. | SO2水溶液能导电,所以SO2是电解质 | |
| B. | NaCl溶液能导电所以NaCl溶液是电解质 | |
| C. | 向醋酸溶液中加入少量氢氧化钠固体,溶液的导电能力降低 | |
| D. | Na2CO3既是钠盐又是碳酸盐 |
分析 A、电解质指:水溶液中或熔融状态下能够导电的化合物;
B、单质,混合物既不是电解质也不是非电解质;
C、导电能力与溶液中离子浓度有关;
D、碳酸钠看阳离子为钠盐,看阴离子为碳酸盐.
解答 解:A.二氧化硫和水反应生成亚硫酸,亚硫酸能电离出自由移动的阴阳离子,所以二氧化硫的水溶液导电,但电离出离子的物质是亚硫酸不是二氧化硫,所以二氧化硫是非电解质,故A错误;
B.氯化钠水溶液为混合物,既不是电解质也不是非电解质,故B错误;
C.醋酸是弱酸,反应后生成的醋酸钠为强电解质,溶液导电能力增强,故C错误;
D.碳酸钠是钠离子和碳酸根离子构成,属于钠盐或碳酸盐,故D正确;故选D.
点评 本题考查了电解质非电解质概念的理解应用,注意概念的实质是关键,题目较简单.

练习册系列答案
相关题目
4.在水溶液中不能存在的反应是( )
①Cl2+2NaBr═2NaCl+Br2
②I2+2NaBr═2NaI+Br2
③Zn+FeSO4═ZnSO4+Fe
④K+NaCl═KCl+Na.
①Cl2+2NaBr═2NaCl+Br2
②I2+2NaBr═2NaI+Br2
③Zn+FeSO4═ZnSO4+Fe
④K+NaCl═KCl+Na.
| A. | ①③ | B. | ①② | C. | ②④ | D. | ③④ |
5.下列关于SO2的叙述,正确的是( )
| A. | SO2既可做氧化剂,又可做还原剂 | |
| B. | SO2是硫酸的酸酐 | |
| C. | 大气中SO2的主要来源是汽车排出的尾气 | |
| D. | SO2具有漂白性,因而可以使石蕊试液褪色 |
2.有下列两组命题
B组中命题正确,且能用A组命题加以正确解释的是( )
| A组 | B组 |
| Ⅰ.H-F键键能小于H-Cl键键能 | ①HCl比HF稳定 |
| Ⅱ.H-I键键能小于H-Cl键键能 | ②HCl比HI稳定 |
| Ⅲ.HCl分子间作用力大于HF分子间作用力 | ③HCl沸点比HF高 |
| Ⅳ.HI分子间作用力小于HCl分子间作用力 | ④HI沸点比HCl低 |
| A. | Ⅰ① | B. | Ⅱ② | C. | Ⅲ③ | D. | Ⅳ④ |
9.咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示.关于咖啡鞣酸的下列说法正确的是( )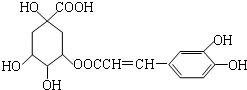
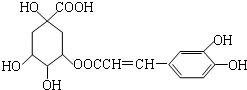
| A. | 分子式为C16H18O9 | |
| B. | 1mol咖啡鞣酸水解时可消耗8molNaOH | |
| C. | 咖啡鞣酸分子中所有原子都在同一平面上 | |
| D. | 与浓溴水既能发生取代反应又能发生加成反应 |
19.下列关于Li、Na、K、Rb、Cs碱金属元素的性质比较中,与事实不完全相符合的是( )
| A. | 原子半径依次增大 | B. | 离子半径依次增大 | ||
| C. | 单质的密度依次逐渐增大 | D. | 氢氧化物的碱性依次增强 |
6.下列有关化学用语表示正确的是( )
| A. | 次氯酸的电子式 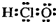 | |
| B. | S2-的结构示意图: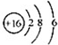 | |
| C. | 质子数为53,中子数为78的碘原子:13153I | |
| D. | NH4I的电子式: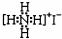 |
3.经测定,由C3H7OH、C2H5OC2H5和C6H12组成的混合物中氧的质量分数为8%,则此混合物中氢的质量分数为( )
| A. | 78% | B. | 22% | C. | 14% | D. | 13% |
10.下列说法正确的是( )
| A. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色 | |
| B. | 棉、丝、羽毛、塑料及合成橡胶完全燃烧都只生成CO2和H2O | |
| C. | 纤维素、合成纤维、光导纤维都是有机高分子化合物 | |
| D. | 液化石油气可由石油分馏获得,汽油可由石油分馏或石油裂化获得 |