题目内容
5.下列关于SO2的叙述,正确的是( )| A. | SO2既可做氧化剂,又可做还原剂 | |
| B. | SO2是硫酸的酸酐 | |
| C. | 大气中SO2的主要来源是汽车排出的尾气 | |
| D. | SO2具有漂白性,因而可以使石蕊试液褪色 |
分析 A.二氧化硫中S元素化合价处于中间价态;
B.二氧化硫属于酸性氧化物,能和水反应生成亚硫酸,为亚硫酸的酸酐;
C.二氧化硫主要来源含硫物质的燃烧;
D.SO2具有漂白性,能使品红褪色.
解答 解:A.二氧化硫中S元素为+4价,处于中间价态,既能被氧化又能被还原,能被酸性高锰酸钾溶液等强氧化剂氧化,能被硫化氢等还原,所以既可以作氧化剂又可以作还原剂,故A正确;
B.酸酐是酸失去1分子水后的氧化物,则硫酸的酸酐为三氧化硫,亚硫酸的酸酐为二氧化硫,故B错误;
C.二氧化硫主要来源含硫物质的燃烧,汽车尾气中主要含氮的氧化物,故C错误;
D.SO2具有漂白性,能使品红褪色,但不能使石蕊试液褪色,遇石蕊试液变红,故D错误;
故选A.
点评 本题考查二氧化硫的性质、来源等知识点,二氧化硫具有氧化性、还原性和漂白性,易错选项是D,注意二氧化硫不能漂白酸碱指示剂,为易错点.

练习册系列答案
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
15.下列过程中不能引入卤素原子的是( )
| A. | 在空气中燃烧 | B. | 取代反应 | C. | 加成反应 | D. | 水解反应 |
16.下列表述或事实解释正确的是( )
| A. | 化石燃料等传统能源不能再生,故传统能源都为一次能源,新能源都是二次能源 | |
| B. | 铝热反应需要能量引发,因为铝热反应为吸热反应 | |
| C. | 增加炼铁高炉的高度可以减轻温室效应,因CO2密度较大 | |
| D. | 增加炼铁高炉的高度并不能减少CO的排放,因为没有改变反应的限度 |
13.某化学兴趣小组的同学为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
试根据表中的实验现象回答下列问题:
(1)实验1和2中Al所作的电极(正极或负极)不相同(填“相同”或“不相同”).
(2)对实验3完成下列填空:
①铝为负极,电极反应式:2Al-6e-═2Al3+.
②石墨为正极,电极反应式:6H++6e-═3H2↑.
③电池总反应方程式:2Al+6H+═2Al3++3H2↑.
(3)实验4中铝作负极,理由是Al失去电子.写出铝电极的电极反应式:Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中电流计指针偏向铝的原因Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝.
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:自发的氧化还原反应中金属铝是否参与反应,金属铝参加反应,失电子作负极,反之作正极.
| 编号 | 电极材料 | 电解质溶液 | 电流计指针 偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
(1)实验1和2中Al所作的电极(正极或负极)不相同(填“相同”或“不相同”).
(2)对实验3完成下列填空:
①铝为负极,电极反应式:2Al-6e-═2Al3+.
②石墨为正极,电极反应式:6H++6e-═3H2↑.
③电池总反应方程式:2Al+6H+═2Al3++3H2↑.
(3)实验4中铝作负极,理由是Al失去电子.写出铝电极的电极反应式:Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中电流计指针偏向铝的原因Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝.
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:自发的氧化还原反应中金属铝是否参与反应,金属铝参加反应,失电子作负极,反之作正极.
10.恒温恒容的密闭容器中盛有2mol SO3,发生反应2SO3(g)?2SO2(g)+O2(g),一定条件下平衡时SO2所占的体积百分数为M,若相同条件相同容器中,最初放入4mol SO3,则平衡时,SO2的体积百分数为N,下列结论正确的是( )
| A. | M=N | B. | M>N | C. | M<N | D. | 无法比较 |
17.一定能在下列溶液中大量共存的离子组为( )
| A. | 含有大量Fe2+的溶液:Na+、NH4+、ClO-、SO42- | |
| B. | 含有大量氨水的溶液:Ca2+、Mg2+、Ba2+、NO3- | |
| C. | 含有大量AlO2-的溶液:Na+、K+、NO3-、CO32- | |
| D. | 含有大量NO3-的溶液:H+、I-、SO42-、Cl- |
14.下列说法中,正确的是( )
| A. | SO2水溶液能导电,所以SO2是电解质 | |
| B. | NaCl溶液能导电所以NaCl溶液是电解质 | |
| C. | 向醋酸溶液中加入少量氢氧化钠固体,溶液的导电能力降低 | |
| D. | Na2CO3既是钠盐又是碳酸盐 |
1.某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).

部分阳离子以氢氧化物形式沉淀时的pH如下:
(1)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑、Al2O3+2OH-=2AlO2-+3H2O.
(2)“酸浸”时所加入的酸是H2SO4 (填化学式);酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+、Fe3+.
(3)加入H2O2时发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O.
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(5)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的(写出一点即可).
(6)NiS04•7H20可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-.
(7)一般认为残留在溶液中的离子浓度小于1×10-5 mol/L时,沉淀已经完全.请利用上表中数据,估算Fe(OH)2的溶度积常数1×10-13.6(mol/L)3,和可逆反应Fe2++2H2O=2H++Fe(OH)2 在25℃时的平衡常数1×10-14.4(mol/L).

部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ai(OH)2 | 7.1 | 9.2 |
(2)“酸浸”时所加入的酸是H2SO4 (填化学式);酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+、Fe3+.
(3)加入H2O2时发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O.
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(5)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的(写出一点即可).
(6)NiS04•7H20可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-.
(7)一般认为残留在溶液中的离子浓度小于1×10-5 mol/L时,沉淀已经完全.请利用上表中数据,估算Fe(OH)2的溶度积常数1×10-13.6(mol/L)3,和可逆反应Fe2++2H2O=2H++Fe(OH)2 在25℃时的平衡常数1×10-14.4(mol/L).
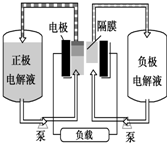 全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟.
全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟.