题目内容
6.下列有关化学用语表示正确的是( )| A. | 次氯酸的电子式 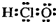 | |
| B. | S2-的结构示意图: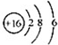 | |
| C. | 质子数为53,中子数为78的碘原子:13153I | |
| D. | NH4I的电子式: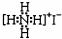 |
分析 A.次氯酸分子的中心原子为O,其分子中不存在氢氯键;
B.硫离子的核外电子总数为18,最外层达到8电子稳定结构;
C.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
D.碘离子为阴离子,电子式中碘离子需要标出其最外层电子.
解答 解:A.次氯酸为共价化合物,分子中不存在氢氯键,次氯酸正确的电子式为: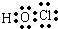 ,故A错误;
,故A错误;
B.硫离子的核电荷数为16、核外电子总数为18,硫离子正确的结构示意图应为: ,故B错误;
,故B错误;
C.碘元素的质子数为53,中子数为78的碘原子的质量数为131,该核素可以表示为:53131I,故C正确;
D.碘化铵为离子化合物,电子式中没有标出碘离子的最外层电子,NH4I正确的电子式: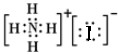 ,故D错误;
,故D错误;
故选C.
点评 本题考查了离子结构示意图、电子式、核素的表示方法,题目难度中等,注意掌握常见化学用语的书写原则,明确次氯酸中不存在氢氯键,其中心原子为O.

练习册系列答案
相关题目
16.下列表述或事实解释正确的是( )
| A. | 化石燃料等传统能源不能再生,故传统能源都为一次能源,新能源都是二次能源 | |
| B. | 铝热反应需要能量引发,因为铝热反应为吸热反应 | |
| C. | 增加炼铁高炉的高度可以减轻温室效应,因CO2密度较大 | |
| D. | 增加炼铁高炉的高度并不能减少CO的排放,因为没有改变反应的限度 |
17.一定能在下列溶液中大量共存的离子组为( )
| A. | 含有大量Fe2+的溶液:Na+、NH4+、ClO-、SO42- | |
| B. | 含有大量氨水的溶液:Ca2+、Mg2+、Ba2+、NO3- | |
| C. | 含有大量AlO2-的溶液:Na+、K+、NO3-、CO32- | |
| D. | 含有大量NO3-的溶液:H+、I-、SO42-、Cl- |
14.下列说法中,正确的是( )
| A. | SO2水溶液能导电,所以SO2是电解质 | |
| B. | NaCl溶液能导电所以NaCl溶液是电解质 | |
| C. | 向醋酸溶液中加入少量氢氧化钠固体,溶液的导电能力降低 | |
| D. | Na2CO3既是钠盐又是碳酸盐 |
11.下列物质不能通过化合反应而得到的是( )
| A. | NO2 | B. | Fe(OH)3 | C. | FeCl2 | D. | H2SiO3 |
1.某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).

部分阳离子以氢氧化物形式沉淀时的pH如下:
(1)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑、Al2O3+2OH-=2AlO2-+3H2O.
(2)“酸浸”时所加入的酸是H2SO4 (填化学式);酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+、Fe3+.
(3)加入H2O2时发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O.
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(5)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的(写出一点即可).
(6)NiS04•7H20可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-.
(7)一般认为残留在溶液中的离子浓度小于1×10-5 mol/L时,沉淀已经完全.请利用上表中数据,估算Fe(OH)2的溶度积常数1×10-13.6(mol/L)3,和可逆反应Fe2++2H2O=2H++Fe(OH)2 在25℃时的平衡常数1×10-14.4(mol/L).

部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ai(OH)2 | 7.1 | 9.2 |
(2)“酸浸”时所加入的酸是H2SO4 (填化学式);酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+、Fe3+.
(3)加入H2O2时发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O.
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(5)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的(写出一点即可).
(6)NiS04•7H20可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-.
(7)一般认为残留在溶液中的离子浓度小于1×10-5 mol/L时,沉淀已经完全.请利用上表中数据,估算Fe(OH)2的溶度积常数1×10-13.6(mol/L)3,和可逆反应Fe2++2H2O=2H++Fe(OH)2 在25℃时的平衡常数1×10-14.4(mol/L).
2.化学与生活、社会密切相关,下列说法错误的是( )
| A. | 玻璃属于无机非金属材料 | B. | 煤的气化属于物理变化 | ||
| C. | 雾霾与汽车尾气的排放有关 | D. | 甲醛的水溶液可以用来浸泡标本 |
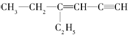 ,分子中饱和碳原子数为4,可能在同一平面上的碳原子数最多为8
,分子中饱和碳原子数为4,可能在同一平面上的碳原子数最多为8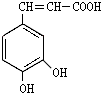 ),存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别对内脏的止血效果较好.
),存在于许多中药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,特别对内脏的止血效果较好. .
.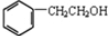 ,咖啡酸跟该芳香醇在一定条件下反应生成CPAE的化学方程式为
,咖啡酸跟该芳香醇在一定条件下反应生成CPAE的化学方程式为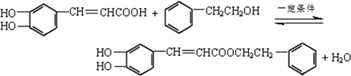 .
.