题目内容
4.在水溶液中不能存在的反应是( )①Cl2+2NaBr═2NaCl+Br2
②I2+2NaBr═2NaI+Br2
③Zn+FeSO4═ZnSO4+Fe
④K+NaCl═KCl+Na.
| A. | ①③ | B. | ①② | C. | ②④ | D. | ③④ |
分析 ①氯气氧化性强于溴,能够从溴化钠溶于中置换溴;
②碘的氧化性弱于溴,与溴化钠不反应;
③锌活泼性强于铁,能够与硫酸亚铁溶液反应置换铁;
④钾性质活泼,与盐溶液反应,先与水反应.
解答 解:①氯气与溴化钠溶液反应生成溴和氯化钠,方程式:Cl2+2NaBr═2NaCl+Br2,故正确;
②碘的氧化性弱于溴,与溴化钠不反应,故错误;
③锌与硫酸亚铁溶液反应生成硫酸锌和铁,方程式:Zn+FeSO4═ZnSO4+Fe,故正确;
④钾与氯化钠溶液反应,先与水反应生成氢氧化钾和氢气,不能置换钠,故错误;
故选C.
点评 本题考查了元素化合物性质,熟悉物质的性质是解题关键,注意钠与盐溶液反应的实质,题目难度不大.

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
14.某化学兴趣小组的同学为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
试根据表中的实验现象回答下列问题:
(1)实验1和2中Al所作的电极(正极或负极)不相同(填“相同”或“不相同”).
(2)实验3中负极反应式:Al-3e-=Al3+;总反应的离子方程式:2Al+6H+═2Al3++3H2↑.
(3)实验4中铝作负极,电极反应式:Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中电流计指针偏向铝的原因Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝.
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
(1)实验1和2中Al所作的电极(正极或负极)不相同(填“相同”或“不相同”).
(2)实验3中负极反应式:Al-3e-=Al3+;总反应的离子方程式:2Al+6H+═2Al3++3H2↑.
(3)实验4中铝作负极,电极反应式:Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中电流计指针偏向铝的原因Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝.
15.下列过程中不能引入卤素原子的是( )
| A. | 在空气中燃烧 | B. | 取代反应 | C. | 加成反应 | D. | 水解反应 |
19.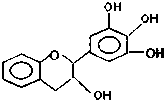 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中不正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中不正确的是( )
 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中不正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中不正确的是( )| A. | EGC分子中所有的原子一定不共面 | |
| B. | 1mol EGC可以与2molBr2发生取代反应 | |
| C. | EGC可以发生氧化反应和取代反应,1mol该物质可以与6molH2发生加成反应 | |
| D. | 1molEGC与3molNa恰好完全反应 |
16.下列表述或事实解释正确的是( )
| A. | 化石燃料等传统能源不能再生,故传统能源都为一次能源,新能源都是二次能源 | |
| B. | 铝热反应需要能量引发,因为铝热反应为吸热反应 | |
| C. | 增加炼铁高炉的高度可以减轻温室效应,因CO2密度较大 | |
| D. | 增加炼铁高炉的高度并不能减少CO的排放,因为没有改变反应的限度 |
13.某化学兴趣小组的同学为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
试根据表中的实验现象回答下列问题:
(1)实验1和2中Al所作的电极(正极或负极)不相同(填“相同”或“不相同”).
(2)对实验3完成下列填空:
①铝为负极,电极反应式:2Al-6e-═2Al3+.
②石墨为正极,电极反应式:6H++6e-═3H2↑.
③电池总反应方程式:2Al+6H+═2Al3++3H2↑.
(3)实验4中铝作负极,理由是Al失去电子.写出铝电极的电极反应式:Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中电流计指针偏向铝的原因Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝.
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:自发的氧化还原反应中金属铝是否参与反应,金属铝参加反应,失电子作负极,反之作正极.
| 编号 | 电极材料 | 电解质溶液 | 电流计指针 偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
(1)实验1和2中Al所作的电极(正极或负极)不相同(填“相同”或“不相同”).
(2)对实验3完成下列填空:
①铝为负极,电极反应式:2Al-6e-═2Al3+.
②石墨为正极,电极反应式:6H++6e-═3H2↑.
③电池总反应方程式:2Al+6H+═2Al3++3H2↑.
(3)实验4中铝作负极,理由是Al失去电子.写出铝电极的电极反应式:Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中电流计指针偏向铝的原因Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝.
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:自发的氧化还原反应中金属铝是否参与反应,金属铝参加反应,失电子作负极,反之作正极.
14.下列说法中,正确的是( )
| A. | SO2水溶液能导电,所以SO2是电解质 | |
| B. | NaCl溶液能导电所以NaCl溶液是电解质 | |
| C. | 向醋酸溶液中加入少量氢氧化钠固体,溶液的导电能力降低 | |
| D. | Na2CO3既是钠盐又是碳酸盐 |
