题目内容
17.氢能是最重要的新能源.储氢作为氢能利用的关键技术,是当前关注的热点之一.(1)氢气是清洁能源,其燃烧产物为水.
(2)NaBH4是一种重要的储氢载体,能与水反应生成NaBO2,且反应前后B的化合价不变,该反应的化学方程式为NaBH4+2H2O=NaBO2+4H2↑,
反应消耗1molNaBH4时转移的电子数目为4NA;
(3)储氢还可借助有机物,如利用环已烷和苯之间的可逆反应来实现脱氢和加氢.
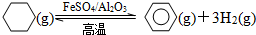
在某温度下,向恒容容器中加入环已烷,其起始浓度为4mol•L-1,平衡时环已烷的转化率为25%,该反应的平衡常数K=27(mol/L)2
(4)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其它有机物).
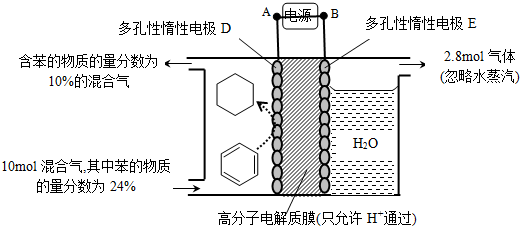
①电源的负极为A(A或B),
导线中电子转移方向为A→D.(用A、D表示)
②生成目标产物环已烷的电极反应式为C6H6+6H++6e-=C6H12.
③高分子电解质膜通过n(H+)=11.2mol.
分析 (1)依据氢气燃烧生成水解答;
(2)依据NaBH4是一种重要的储氢载体,能与水反应生成NaBO2,且反应前后B的化合价不变,可知H元素化合价由-1价、+1价变为0价,再结合转移电子守恒书写化学方程式;
依据方程式及化合价变化计算转移电子数目;
(3)依据平衡产数表达式计算解答;
(4)①根据图知,苯中的碳得电子生成环己烷,则D作阴极,E作阳极,所以A是负极、B是正极,电子从负极流向阴极;
②该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷;
③阳极上生成氧气,同时生成氢离子,电极反应式为:2H2O-4e-=4H++O2,据此计算转移氢离子的物质的量.
解答 解:(1)氢气燃烧生成水,没有污染;
故答案为:水;
(2)NaBH4是一种重要的储氢载体,能与水反应生成NaBO2,且反应前后B的化合价不变,所以NaBH4与H2O发生归中反应,生成NaBO2和氢气,H元素化合价由-1价、+1价变为0价,依据得失电子守恒可知:NaBH4的系数为1,H2O的系数为2,依据原子个数守恒,反应方程式:NaBH4+2H2O=NaBO2+4H2↑;
反应中NaBH4中的-1价的氢升高到氢气中的0价,消耗1molNaBH4,失去4mol电子,转移的电子数目4NA;
故答案为:NaBH4+2H2O=NaBO2+4H2↑;4NA;
(3)依据转化量等于计量系数之比,列三段:
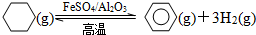
起始浓度(mol/L) 4 0 0
转化浓度(mol/L) 4×25% 4×25% 3×4×25%
平衡浓度(mol/L) 1 1 3
反应平衡常数=$\frac{[C{\;}_{6}{H}_{6}][{H}_{2}]^{3}}{[{C}_{6}{H}_{12}]}$=$\frac{1×{3}^{3}}{1}$=27(mol/L)2;
故答案为:27(mol/L)2;
(4)①根据图知,苯中的碳得电子生成环己烷,则D作阴极,E作阳极,所以A是负极、B是正极,电子从负极流向阴极即从A→D;
故答案为:A;A→D;
②该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,
故答案为:C6H6+6H++6e-=C6H12;
③阳极上生成氧气,同时生成氢离子电极反应式2H2O-4e-=4H++O2,生成1mol氧气转移4mol电子,则生成2.8mol氧气,转移11.2mol电子;
故答案为:11.2mol.
点评 本题考查了化学平衡、电解池原理等知识点,熟悉化学平衡常数表达式、电解池工作原理是解题关键,题目难度较大.

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案| A. | H、D、T属于同位素,H2、D2、T2属于同素异形体 | |
| B. | 氯水、氨水、王水是混合物,水银、水玻璃是纯净物 | |
| C. | 冰醋酸、纯碱、小苏打分别属于酸、碱、盐 | |
| D. | 水能、风能、生物质能是可再生能源,煤、石油、天然气是不可再生能源 |
| A. | 使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| B. | PH=13的溶液:Na+、Cu2+、HCO3-、NO3- | |
| C. | 水电离出的c(H+)=10-12mol/L的溶液:K+、Na+、CO32-、Br- | |
| D. | 有较多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3- |
 ,下列有关说法正确的是( )
,下列有关说法正确的是( )| A. | 邻苯二甲酸二丁酯的分子式为CHO4 | |
| B. | 邻苯二甲酸二丁酯属于酯类,可增加白酒的香味,对人体无害 | |
| C. | 用邻苯二甲酸与丁醇合成邻苯二甲酸二丁酯的反应属于取代反应 | |
| D. | 邻苯二甲酸二丁酯不能发生加成反应 |
| A. | 钠原子与氯气反应生成食盐后,其结构的稳定性增强 | |
| B. | 第IA族的元素与卤素结合时,一定形成离子键 | |
| C. | 任何单质在离子键的形成过程中必定有电子的得与失 | |
| D. | 钠与氧气反应生成氧化钠后,体系的能量降低 |
| A. | 14g CO2 | B. | 1lg CO2、3g CO | C. | CO、CO2各7g | D. | 14g CO |
 ;
;