题目内容
7.(1)0.4mol OH-的质量为6.8g,其中含有2.408×1024个电子;(2)质量相同的H2、NH3、SO2、NO2四种气体中,含有分子数目最少的是SO2,在相同温度和相同压强条件下,体积最大的是H2.
分析 (1)m=nM,一个氢氧根离子中含有10个电子,根据氢氧根离子构成计算;
(2)根据N=$\frac{m}{M}$×NA可知摩尔质量越大,含有的分子数越小;根据V=$\frac{m}{M}$×Vm可知,摩尔质量越小,气体体积越大.
解答 解:(1)0.4mol OH-的质量m=nM=0.4mol×17g/mol=6.8g;一个氢氧根离子中含有10个电子,0.4mol OH-中含有电子数=0.4mol×10×6.02×1023/mol=2.408×1024,
故答案为:6.8g;2.408×1024;
(2)质量相同的H2、NH3、SO2、O3四种气体中,由N=$\frac{m}{M}$×NA可知,质量相同时气体分子数与摩尔质量成反比,摩尔质量越大,含有的分子数越小,所以含有分子数最少的是摩尔质量最大的二氧化硫;由V=$\frac{m}{M}$×Vm可知,质量相同时,气体体积与摩尔质量成反比,体积增大的是气体摩尔质量最小的,即氢气,
故答案为:SO2; H2.
点评 本题考查了阿伏伽德罗常数、物质的量的简单计算,题目难度不大,注意掌握物质的量与阿伏伽德罗常数、摩尔质量、气体摩尔体积之间的关系,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
18.下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是( )
| A | B | C | D | |
| X | FeCl2溶液 | FeCl2溶液 | Fe | FeSO4溶液 |
| Y | FeCl3 | CuCl2 | Al | Fe2(SO4)3 |
| Z | Cl2 | Fe | NaOH溶液 | Cu |
| A. | A | B. | B | C. | C | D. | D |
15.在火星上工作的美国“勇气号”、“机遇号”探测车的一个重要任务就是收集有关Fe2O3及硫酸盐的信息,以证明火星上存在或曾经存在过水,以下叙述正确的是( )
| A. | Fe2O3是一种酸性氧化物 | |
| B. | 检验从火星上带回来的红色物质是否是Fe2O3的操作步骤为:样品-→粉碎-→加水溶解-→过滤-→向滤液中滴加KSCN溶液 | |
| C. | 分别还原a mol Fe2O3所需H2、Al、CO的物质的量之比为 3:2:3 | |
| D. | 明矾属硫酸盐,含结晶水,是混合物 |
19.下列溶液的物质的量浓度是0.5mol/L的是( )
| A. | 20g NaOH溶于1L水中 | |
| B. | 58.5g NaCl溶于水配成1L溶液 | |
| C. | 28g KOH溶于水配成1L溶液 | |
| D. | 通常状况下,11.2L HCl气体溶于水配成1L溶液 |
3.下列离子方程式正确的是( )
| A. | 盐酸中滴加氨水:H++OH-═H2O | |
| B. | 用FeCl3溶液腐蚀铜线路板:Cu+Fe3+═Cu2++Fe2+ | |
| C. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 将氯气溶于水制备次氯酸:Cl2+H2O═2H++Cl-+ClO- |
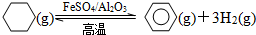

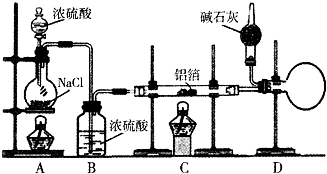 无水氯化铝是有机化工常用的催化剂,氯化铝178℃时升华,极易潮解,遇水发热并产生白色烟雾.氯化铝还易溶于乙醇、氯仿和四氯化碳.实验室可用反应2Al+6HCl(g)$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3H2制备少量无水氯化铝,某同学利用该原理设计如下实验装置:
无水氯化铝是有机化工常用的催化剂,氯化铝178℃时升华,极易潮解,遇水发热并产生白色烟雾.氯化铝还易溶于乙醇、氯仿和四氯化碳.实验室可用反应2Al+6HCl(g)$\frac{\underline{\;\;△\;\;}}{\;}$2AlCl3+3H2制备少量无水氯化铝,某同学利用该原理设计如下实验装置: