题目内容
8.现有浓度均为0.1mol•L-1的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵请回答下列问题:
(1)四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)④②③①.
(2)将②和③等体积混合后,混合液中各离子浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+).
(3)已知T℃,KW=1×10-13,则T℃>25℃(填“>”“<”或“=”).在T℃时pH=3的①溶液中由水电离出来的c(H+)=10-10mol/L,由水电离出来的c(OH-)=10-10mol/L.
(4)上述中0.1mol•L-1的④溶液呈酸性,其原因是NH4++H2O=NH3•H2O+H+(用离子方程式解释),其溶液中离子浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-).
(5)氨在国民经济中占有重要地位,他极易溶于水,所得溶液称为氨水,其溶液显弱碱性,写出其电离方程式NH3•H2O?NH4++OH-,向其溶液中加入少量的④固体,平衡向左移动(填“向左”“向右”或“不移动”),则溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$值减小(填“增大”“减小”或“不变”).
分析 (1)酸或碱抑制水电离,含有弱根离子的盐促进水电离;
(2)醋酸与氢氧化钠等体积、等浓度混合后生成醋酸钠,醋酸根离子水解溶液显示碱性;
(3)水的电离是吸热反应,升高温度促进水电离;硫酸溶液中的氢氧根离子是水电离的,根据溶液的pH=3计算出由水电离产生的c(OH-)和c(H+);
(4)强酸弱碱盐在溶液中水解显酸性;氯化铵溶液中氯离子浓度大于铵根离子浓度,氢离子浓度大于氢氧根离子浓度;
(5)弱电解质在溶液中部分电离;根据同离子效应判断电离平衡移动方向;根据平衡移动判断溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$值的变化.
解答 解:(1)④氯化铵为强酸弱碱盐,水解促进水的电离,②醋酸为弱酸,溶液中c(H+)较小,①硫酸和③氢氧化钠都为强电解质,浓度相同时,硫酸对水的电离抑制程度较大,所以四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①,
故答案为:④②③①;
(2)将②和③等体积混合后,反应生成醋酸钠,醋酸根离子水解,溶液显示碱性,则混合液中各离子浓度由大到小的顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(3)水的电离是吸热反应,升高温度促进水电离,则水的离子积常数增大,t℃时,Kw=1×10-13>10-14,所以t℃>25℃;
已知t℃,KW=1×10-13,在t℃时pH=3的硫酸溶液中,硫酸电离的氢离子抑制了水的电离,硫酸溶液中的氢氧根离子是水电离的,由水电离产生的c(OH-)=10-10mol/L,则水电离的c(H+)=10-10mol/L;
故答案为:>;10-10mol/L;10-10mol/L;
(4)氯化铵属于强酸弱碱盐在溶液中水解显酸性,其水解离子方程式为:NH4++H2O?NH3•H2O+H+;氯化铵溶液中氯离子浓度大于铵根离子浓度,氢离子浓度大于氢氧根离子浓度,则溶液中离子浓度大小顺序为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
故答案为:NH4++H2O=NH3•H2O+H+;c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(5)NH3•H2O是弱电解质在溶液中部分电离,溶液显弱碱性,其电离方程式为:NH3•H2O?NH4++OH-;向氨水中加氯化铵,铵根离子浓度增大,电离平衡向左移动,溶液中氢离子浓度减小,则氢氧根离子浓度增大,所以溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$值的减小;
故答案为:NH3•H2O?NH4++OH-;向左;减小.
点评 本题考查了水的电离、盐的水解及溶液中离子浓度大小的比较,题目难度中等,注意温度影响水的离子积,温度不同,水的离子积不同.

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案| A. | 室温下,14.0g乙烯和丁烯的混合气体中含有的C-H键数目为2NA | |
| B. | 2molSO2和1molO2在一定条件下充分反应后,所得混合气体的分子数大于2NA | |
| C. | 2.3g金属钠与过量的氧气反应,无论是否加热,转移的电子数均为0.1NA | |
| D. | 1mol Na2CO3晶体中含有的CO32-离子数小于NA |
| A. | S | B. | Fe | C. | Si | D. | Cl |
①取代反应 ②加成反应 ③使溴水褪色④使酸性KMnO4溶液褪色 ⑤酯化反应 ⑥聚合反应.
| A. | 以上反应均可发生 | B. | 只有⑤不能发生 | ||
| C. | 只有⑥不能发生 | D. | 只有②不能发生 |
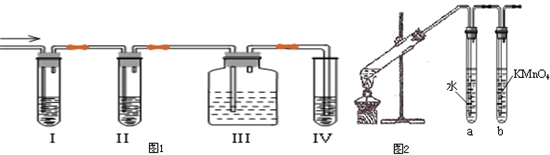
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 滴定时,左手控制滴定管活塞,右手握持锥形瓶,眼睛注视滴定管中的液面 | |
| D. | 用精密pH试纸测得溶液的pH为4.2 |
| A | B | C | D | |
| X | FeCl2溶液 | FeCl2溶液 | Fe | FeSO4溶液 |
| Y | FeCl3 | CuCl2 | Al | Fe2(SO4)3 |
| Z | Cl2 | Fe | NaOH溶液 | Cu |
| A. | A | B. | B | C. | C | D. | D |