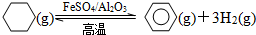题目内容
9.X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大.(1)Y的最高价氧化物的电子式为
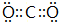 ;
;(2)相同条件下XZ2与YZ2分子两者在水中的溶解度较大的是SO2(写分子式),理由是SO2是极性分子,H2O也是极性分子,而CO2是非极性分子,相似相溶;
(3)Q的元素符号是Cr,它的核外电子排布式为1s22s22p63s23p63d54s1,
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键F-H…F、F-H…O;O-H…F、O-H…O.
分析 X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,为S元素,Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,故Y为C元素,Z是地壳内含量最高的元素,为O元素,Q的核电荷数是X与Z的核电荷数之和,原子序数为24,为Cr元素,E在元素周期表的各元素中电负性最大,应为F元素,结合元素对应单质、化合物的结构和性质解答该题.
解答 解:X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,为S元素,Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,故Y为C元素,Z是地壳内含量最高的元素,为O元素,Q的核电荷数是X与Z的核电荷数之和,原子序数为24,为Cr元素,E在元素周期表的各元素中电负性最大,应为F元素.
(1)Y的最高价氧化物为CO2,电子式为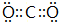 ,故答案为:
,故答案为: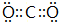 ;
;
(2)SO2中,S和O形成2个δ键,有1个孤电子对,为V形结构,SO2是极性分子,CO2为直线形,属于非极性分子,H2O是极性分子,相似相溶,故SO2在水中溶解度更大,
故答案为:SO2;SO2是极性分子,H2O也是极性分子,而CO2是非极性分子,相似相溶;
(3)Q为Cr,原子序数为24,核外电子排布式为1s22s22p63s23p63d54s1,
故答案为:Cr;1s22s22p63s23p63d54s1;
(4)HF的水溶液中,F的电负性较大,可与另一分子的HF或水中的H形成氢键,可表示为H-F…H,氧原子和氟化氢分子中的氢原子之间能形成氢键,可表示为 F-H…O,氟原子和水分子中的氢原子能形成氢键可表示为O-H…F,氧原子和另一个水分子中的氢原子能形成氢键可表示为O-H…O,
故答案为:F-H…F、F-H…O;O-H…F、O-H…O.
点评 本题是对物质结构与性质的考查,涉及电子式、核外电子排布、分子结构与性质、氢键等,题目难度不大,推断元素的种类是关键.

| A. | 室温下,14.0g乙烯和丁烯的混合气体中含有的C-H键数目为2NA | |
| B. | 2molSO2和1molO2在一定条件下充分反应后,所得混合气体的分子数大于2NA | |
| C. | 2.3g金属钠与过量的氧气反应,无论是否加热,转移的电子数均为0.1NA | |
| D. | 1mol Na2CO3晶体中含有的CO32-离子数小于NA |
| A. | FeS2是还原剂,发生氧化反应 | |
| B. | FeSO4是还原产物 | |
| C. | 每生成1molH2SO4,转移14mol电子 | |
| D. | 反应中H2O既不是氧化剂也不是还原剂 |
| A. | 空气液化制取氮气 | B. | 蒸馏法将海水淡化为饮用水 | ||
| C. | 过滤、蒸发将粗盐提纯 | D. | 酸雨侵蚀建筑物 |
| A | B | C | D | |
| X | FeCl2溶液 | FeCl2溶液 | Fe | FeSO4溶液 |
| Y | FeCl3 | CuCl2 | Al | Fe2(SO4)3 |
| Z | Cl2 | Fe | NaOH溶液 | Cu |
| A. | A | B. | B | C. | C | D. | D |
| A. | 20g NaOH溶于1L水中 | |
| B. | 58.5g NaCl溶于水配成1L溶液 | |
| C. | 28g KOH溶于水配成1L溶液 | |
| D. | 通常状况下,11.2L HCl气体溶于水配成1L溶液 |