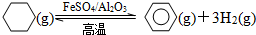题目内容
5.下列各组离子在指定溶液中一定能大量共存的是( )| A. | 使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| B. | PH=13的溶液:Na+、Cu2+、HCO3-、NO3- | |
| C. | 水电离出的c(H+)=10-12mol/L的溶液:K+、Na+、CO32-、Br- | |
| D. | 有较多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3- |
分析 A.使甲基橙变红色的溶液为酸性溶液,四种离子之间不反应,都不与酸性溶液中的氢离子反应;
B.碳酸氢根离子与铜离子发生双水解反应,在溶液中一定不能大量共存;
C.水电离出的c(H+)=10-12mol/L的溶液中存在大量氢离子或氢氧根离子,碳酸根离子与氢离子反应;
D.铁离子与硫氰根离子、碳酸氢根离子发生反应.
解答 解:A.使甲基橙变红色的溶液中存在大量氢离子,Mg2+、K+、SO42-、NO3-之间不反应,都不与氢离子反应,在溶液中能够大量共存,故A正确;
B.Cu2+、HCO3-之间发生双水解反应,在溶液中一定不能大量共存,故B错误;
C.水电离出的c(H+)=10-12mol/L的溶液为酸性或碱性溶液,CO32-与酸性溶液中的氢离子反应,在酸性溶液中不能大量共存,故C错误;
D.Fe3+与SCN-、HCO3-发生反应,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;是“可能”共存,还是“一定”共存等.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
15.在化工生产和科学研究中各种酸具有重要的用途.
(1)磷酸是一种三元中强酸,在溶液中各种含P粒子的百分数(δ)与溶液的pH关系如图:则磷酸的第二级电离平衡常数约为10-7;Na2HPO4溶液的pH约为10,说明HPO4-水解程度大于电离程度(用其电离与水解程度来解释),Na2HPO4溶液的物料守恒式为c(Na+)=2[c(H3PO4)+c(H2PO4-)+c(HPO42-)+c(PO43-)].
(2)乙酸(用HAC来表示)是一种重要的化工原料也可作溶剂.HClO4、HCl、HNO3、H2SO4在无水乙酸中都是弱酸,存在如下电离平衡(电离常数均为常温下的数值):
HClO4+HAC═H2AC++ClO4-K═1.6×10-5
HCl+HAC═H2AC++Cl-K═1.6×10-9
HNO3+HAC═H2AC++NO3-K═4.2×10-10
H2SO4+HAC═H2AC++HSO4-K═6.3×10-9
①H2AC+的名称为乙酸合氢离子;用乙酸作溶剂时,HClO4、HCl、HNO3、H2SO4的酸性由强到弱的排序为HClO4、H2SO4、HCl、HNO3;在0.01mol/L HNO3的乙酸溶液中,c(NO3-)=2×10-6(计算结果保留一位有效数字).
②已知如表酸在水中的电离常数(25℃)
则在相同条件下0.1mol/L HClO4的乙酸溶液与0.1 mol/L HAc水溶液导电能力最接近.
(3)混酸(浓硫酸和浓硝酸的混合物)是常用的硝化试剂,其中含有硝化反应的中间体NO2+,其反应是:2H2SO4+HNO3═[NO2]+[HSO4]-+[H3O+][HSO4]-.根据中和反应的原理判断此反应中HNO3作为碱;NO2+与CO2或N2O或N3-或-OCN(填化学式)的原子数和电子数相同、结构相似;H3O+的空间构型为三角锥形.
(1)磷酸是一种三元中强酸,在溶液中各种含P粒子的百分数(δ)与溶液的pH关系如图:则磷酸的第二级电离平衡常数约为10-7;Na2HPO4溶液的pH约为10,说明HPO4-水解程度大于电离程度(用其电离与水解程度来解释),Na2HPO4溶液的物料守恒式为c(Na+)=2[c(H3PO4)+c(H2PO4-)+c(HPO42-)+c(PO43-)].
(2)乙酸(用HAC来表示)是一种重要的化工原料也可作溶剂.HClO4、HCl、HNO3、H2SO4在无水乙酸中都是弱酸,存在如下电离平衡(电离常数均为常温下的数值):
HClO4+HAC═H2AC++ClO4-K═1.6×10-5
HCl+HAC═H2AC++Cl-K═1.6×10-9
HNO3+HAC═H2AC++NO3-K═4.2×10-10
H2SO4+HAC═H2AC++HSO4-K═6.3×10-9
①H2AC+的名称为乙酸合氢离子;用乙酸作溶剂时,HClO4、HCl、HNO3、H2SO4的酸性由强到弱的排序为HClO4、H2SO4、HCl、HNO3;在0.01mol/L HNO3的乙酸溶液中,c(NO3-)=2×10-6(计算结果保留一位有效数字).
②已知如表酸在水中的电离常数(25℃)
| 酸 | HCN | HAc | HF | H2SO3 |
| Ka | 4.9×10-10 | 1.75×10-5 | 3.5×10-4 | K1=1.5×10-2 |
(3)混酸(浓硫酸和浓硝酸的混合物)是常用的硝化试剂,其中含有硝化反应的中间体NO2+,其反应是:2H2SO4+HNO3═[NO2]+[HSO4]-+[H3O+][HSO4]-.根据中和反应的原理判断此反应中HNO3作为碱;NO2+与CO2或N2O或N3-或-OCN(填化学式)的原子数和电子数相同、结构相似;H3O+的空间构型为三角锥形.

16.元素的原子核外有四个电子层,其3d能级上的电子数是4s能级上的3倍,则此元素是( )
| A. | S | B. | Fe | C. | Si | D. | Cl |
13.下列实验操作错误的是( )
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 滴定时,左手控制滴定管活塞,右手握持锥形瓶,眼睛注视滴定管中的液面 | |
| D. | 用精密pH试纸测得溶液的pH为4.2 |
10.下列有关溶液的说法不正确的是( )
| A. | 溶液由溶质和溶剂组成,所以每种溶液里只有两种物质 | |
| B. | 硫酸钠溶液能导电是因为溶液中含有较多自由移动的离子 | |
| C. | 配置0.09%的生理盐水的一般步骤是计算、称量和溶解 | |
| D. | 在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水中 |
14.已知一定条件下,黄铁矿与硫酸铁溶液反应的化学方程式为FeS2+7Fe2(SO4)3+8H2O═15FeSO4+8H2SO4,下列说法错误的是( )
| A. | FeS2是还原剂,发生氧化反应 | |
| B. | FeSO4是还原产物 | |
| C. | 每生成1molH2SO4,转移14mol电子 | |
| D. | 反应中H2O既不是氧化剂也不是还原剂 |
15.在火星上工作的美国“勇气号”、“机遇号”探测车的一个重要任务就是收集有关Fe2O3及硫酸盐的信息,以证明火星上存在或曾经存在过水,以下叙述正确的是( )
| A. | Fe2O3是一种酸性氧化物 | |
| B. | 检验从火星上带回来的红色物质是否是Fe2O3的操作步骤为:样品-→粉碎-→加水溶解-→过滤-→向滤液中滴加KSCN溶液 | |
| C. | 分别还原a mol Fe2O3所需H2、Al、CO的物质的量之比为 3:2:3 | |
| D. | 明矾属硫酸盐,含结晶水,是混合物 |