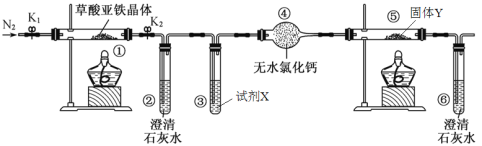
题目内容
【题目】下图是元素周期表的一部分,根据① ~ ⑨在周期表中的位置按题目要求回答:
族 周期 | IA | 0 | ||||||||
1 | ⅡA | …… …… …… | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
2 | ① | ② | ||||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||||
4 | ⑧ | ⑨ | ⑩ | |||||||
(1)画出⑩的原子结构示意图_________________________
(2)①与②形成的一种化合物甲,甲在大气含量过高会产生温室效应,写出甲物质的结构式 __________________________________。
(3)元素③⑤对应的最高价氧化物的水化物,写出它们相互之间能发生反应化学方程式__________________。
(4)元素⑦和⑨形成的化合物乙,请用电子式表示物质乙的形成过程__________________。
(5)②、⑥分别形成的两种氢化物中,沸点较高的是______(填化学式),原因是:___________________________________________________ 。
【答案】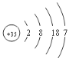 O=C=O NaOH+Al(OH)3=NaAlO2+2H2O
O=C=O NaOH+Al(OH)3=NaAlO2+2H2O  H2O 水分子中含有氢键,故水的沸点高于硫化氢
H2O 水分子中含有氢键,故水的沸点高于硫化氢
【解析】
根据元素周期表得出①为C、②为O、③为Na、④为Mg、⑤为Al、⑥为S、⑦为Cl、⑧为K、⑨为Ca、⑩为Br,然后分析。
(1)⑩为Br,原子序数为35,原子结构示意图为 ;
;
(2)①与②形成的一种化合物甲,甲在大气含量过高会产生温室效应,甲物质为二氧化碳,碳与每个氧共用两对电子,其结构式为O=C=O;
(3)元素③⑤对应的最高价氧化物的水化物分别为NaOH、Al(OH)3,NaOH与Al(OH)3反应生成NaAlO2,它们相互之间能发生反应化学方程式NaOH+Al(OH)3=NaAlO2+2H2O;
(4)元素⑦和⑨形成的化合物乙为CaCl2,电子式表示物质乙的形成过程是两个氯原子和一个钙原子反应生成CaCl2,电子式表示物质乙的形成过程 ;
;
(5)②、⑥分别形成的两种氢化物分别是水和硫化氢,都是分子晶体,硫化氢分子间主要存在范德华力,但水分子中含有氢键,故水的沸点高于硫化氢。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】在2L密闭容器内,800℃时NO(g)和O2(g)反应生成NO2(g)的体系中,n(NO)随时间的变化如表所示:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应,在第5s时,NO的转化率为________。
(2)如图中表示O2变化曲线的是________,用O2表示从0~2s内该反应的平均速率v=________。
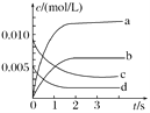
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内气体总质量保持不变
c.v逆(NO)=2v正(O2) d.容器内气体密度保持不变