题目内容
【题目】科学家开发出了多种太阳能电池,除晶体硅太阳能电池外,还有GaAs太阳能电池、铜铟镓硒薄膜太阳能电池等。
(1)基态Ga原子的电子排布式为________。
(2)高温下CuO容易转化为Cu2O,试从原子结构角度解释原因________________。
(3)H2Se分子的键角_______H2O分子的键角(选填“>”、“=”或“<”)。写出与SeO3互为等电子体的一种阴离子_____________(写化学式)。
(4) AsF3分子的立体构型为__________;AsF3是极性分子,理由是_________________。
(5)Ga(OH)3与NaOH溶液反应生成Na[Ga(OH)4]。Na[Ga(OH)4]溶液中含有的化学键有__________________。
A.共价键 B.离子键 C.金属键 D.配位键 E.氢键
(6)金刚砂(SiC)晶胞如图所示:

金刚砂中硅原子的杂化轨道类型为_______,沿晶胞图中虚线方向的切面图为__________(填标号)。

【答案】[Ar]3d104s24p1 Cu2+的价电子排布为3d9,而Cu+为3d10的全充满稳定结构 < CO32-、NO3- 三角锥形 分子中正、负电荷中心不重合 AD sp3 a
【解析】
(1)Ga是31号元素,根据构造原理,书写其核外电子排布式;
(2)原子核外电子所处的轨道为全满、半满、全空时是稳定结构,根据Cu2+、Cu+的核外电子排布分析;
(3)根据中心原子的半径大小及电负性大小分析判断键角;根据等电子体是分子中原子数相同,最外层电子数也相同的特点推断;
(4)根据价层电子对数及含有的孤电子对数判断AsF3分子的立体构型;从分子的对称性判断分子是否为极性分子;
(5)在Na[Ga(OH)4]溶液电离为Na+、[Ga(OH)4]-,在OH-中的O-H键为极性共价键,在Ga与OH-存在配位键;
(6)根据Si原子最外层电子数及形成SiC中的化学键数目判断其杂化类型,结合图示判断沿晶胞图中虚线方向的切面图的形状。
(1)根据构造原理,31号元素Ga的核外电子排布式为[Ar]3d104s24p1;
(2)Cu+的核外电子排布式为1s22s22p63s23p63d10,其价电子排布式为:3d10,Cu2+的核外电子排布式为1s22s22p63s23p63d9,价电子排布式为:3d9,由于Cu+为3d10全充满更稳定,所以在高温下CuO能分解生成Cu2O;
(3)由于O原子半径比Se原子半径小,电负性大,使水滴在中的成键电子对更靠近中心原子,产生的排斥作用大,所以键角比H2Se中的大;
SeO3含有的原子数为4,最外层电子总数为24,则SeO3与互为等电子体的阴离子可以是CO32-或NO3-;
(4)AsF3的中性原子As原子的价层电子对数为3+![]() =4,且As原子上有一对孤电子对,所以AsF3分子的立体构型为三角锥形;在AsF3分子中,由于AsF3分子的立体构型为三角锥形,负电荷重心在F原子一侧,正电荷重心在As原子一侧,使得该物质分子中正、负电荷中心不重合,因此该分子为极性分子;
=4,且As原子上有一对孤电子对,所以AsF3分子的立体构型为三角锥形;在AsF3分子中,由于AsF3分子的立体构型为三角锥形,负电荷重心在F原子一侧,正电荷重心在As原子一侧,使得该物质分子中正、负电荷中心不重合,因此该分子为极性分子;
(5)在Na[Ga(OH)4]溶液中,Na[Ga(OH)4]电离为Na+、[Ga(OH)4]-,在OH-中的O-H键为极性共价键,Ga原子最外层有3个电子,因此在Ga与OH-存在配位键,所以在Na[Ga(OH)4]溶液中,存在的化学键有共价键、配位键,故合理选项是AD;
(6)由于Si原子最外层有4个电子,在SiC中,每个Si原子与四个相邻的C原子形成了4个的共价键,所以Si杂化轨道类型为sp3杂化,结合图示判断沿晶胞图中虚线方向的切面图的形状为a。

【题目】下图是元素周期表的一部分,根据① ~ ⑨在周期表中的位置按题目要求回答:
族 周期 | IA | 0 | ||||||||
1 | ⅡA | …… …… …… | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
2 | ① | ② | ||||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||||
4 | ⑧ | ⑨ | ⑩ | |||||||
(1)画出⑩的原子结构示意图_________________________
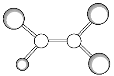
(2)①与②形成的一种化合物甲,甲在大气含量过高会产生温室效应,写出甲物质的结构式 __________________________________。
(3)元素③⑤对应的最高价氧化物的水化物,写出它们相互之间能发生反应化学方程式__________________。
(4)元素⑦和⑨形成的化合物乙,请用电子式表示物质乙的形成过程__________________。
(5)②、⑥分别形成的两种氢化物中,沸点较高的是______(填化学式),原因是:___________________________________________________ 。