题目内容
【题目】下列热化学方程式中,正确的是( )
A.甲烷燃烧热为890.3 kJmol-1,热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=+890.3 kJmolˉ1
B.稀盐酸和稀氢氧化钠溶液混合,其热化学方程式为:H++OH-=H2O △H=-57.3 kJmolˉ1
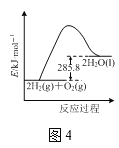
C.H2燃烧热为285.8kJmolˉ1,燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(1) △H=-571.6 kJmolˉ1
D.500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6 kJ·mol-1
2NH3(g) △H=-38.6 kJ·mol-1
【答案】C
【解析】
A.甲烷的燃烧热为890.3 kJmolˉ1表示1 mol甲烷完全燃烧产生CO2气体和液态水时放出热量是890.3 kJ,则表示其燃烧热的化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJmolˉ1,A错误;
B.物质反应过程的能量变化不仅与反应的物质的多少有关,也与物质的存在状态有关,因此要注明物质的存在状态,稀盐酸和稀氢氧化钠溶液混合反应产生水的热化学方程式为:H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJmolˉ1,B错误;
C.H2燃烧热为285.8kJmolˉ1,表示1 mol H2完全燃烧产生1 mol液态H2O,放出285.8 kJ的热量,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(1) △H=-571.6 kJmolˉ1,C项正确;
D.合成氨为可逆反应,0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成氨气的物质的量小于1 mol,放热19.3 kJ,则热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H<-38.6kJ·mol-1,D错误;
2NH3(g) △H<-38.6kJ·mol-1,D错误;
故合理选项是C。

【题目】下图是元素周期表的一部分,根据① ~ ⑨在周期表中的位置按题目要求回答:
族 周期 | IA | 0 | ||||||||
1 | ⅡA | …… …… …… | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
2 | ① | ② | ||||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||||
4 | ⑧ | ⑨ | ⑩ | |||||||
(1)画出⑩的原子结构示意图_________________________
(2)①与②形成的一种化合物甲,甲在大气含量过高会产生温室效应,写出甲物质的结构式 __________________________________。
(3)元素③⑤对应的最高价氧化物的水化物,写出它们相互之间能发生反应化学方程式__________________。
(4)元素⑦和⑨形成的化合物乙,请用电子式表示物质乙的形成过程__________________。
(5)②、⑥分别形成的两种氢化物中,沸点较高的是______(填化学式),原因是:___________________________________________________ 。